
【题目】一种制备N2H4·H2O(水合肼)和无水Na2SO3的主要实验流程如下:

已知:温度超过40 ℃,Cl2与NaOH溶液反应会生成副产物NaClO3。
⑴“反应Ⅰ”中NaOH应过量且同时减慢通入Cl2的速率,目的是______。
⑵常温时,将Cl2通入NaOH溶液中,一段时间后溶液中将有NaClO3生成,原因是______。
⑶写出“反应Ⅱ”中NaClO与(NH2)2CO反应的化学方程式:______。
⑷“反应Ⅲ”中会有气体______(填化学式)生成,检验有该气体的方法是______。
⑸图所示为Na2SO3的溶解度随温度的变化曲线,由质量分数为10%的Na2SO3溶液制取无水Na2SO3的方法是______。

【答案】提高Cl2的吸收率,防止Cl2污染环境 Cl2与NaOH溶液反应放热 NaClO+(NH2)2CO+2NaOH=Na2CO3+N2H4·H2O+NaCl CO2 将气体先通过足量的酸性KMnO4溶液,再通过澄清石灰水,若石灰水变浑浊,则存在CO2,若不变浑浊,则不存在CO2 将溶液加热浓缩至有大量晶体析出,在高于34℃条件下趁热过滤
【解析】
由实验流程可知反应I为氯气和氢氧化钠溶液的反应,生成NaClO,为避免生成NaClO3,应控制温度在40C以下,生成的NaClO与尿素反应生成N2H4H2O和Na2CO3,可用蒸馏的方法分离出N2H4H2O,副产品Na2CO3溶液中通入过量二氧化硫,得到NaHSO3,加入氢氧化钠,可制得Na2SO3。
(1)Cl2有毒,通入过快未反应的氯气会污染空气,NaOH应过量,可增加对氯气的吸收效率,
答案为:提高Cl2的吸收率,防止Cl2污染环境;
⑵Cl2与NaOH溶液反应放热,温度超过40 ℃,Cl2与NaOH溶液反应会生成副产物NaClO3,
答案为:Cl2与NaOH溶液反应放热
⑶写出“反应Ⅱ”中碱性条件下,NaClO与尿素反应生成N2H4H2O和Na2CO3,化学方程式:NaClO+(NH2)2CO+2NaOH=Na2CO3+N2H4·H2O+NaCl,
答案为:NaClO+(NH2)2CO+2NaOH=Na2CO3+N2H4·H2O+NaCl;
⑷根据分析,副产品Na2CO3溶液中通入过量二氧化硫,二氧化硫溶于水生成亚硫酸,亚硫酸酸性强于碳酸,与碳酸钠反应生成二氧化碳气体,检验有二氧化碳存在首先要排除二氧化硫气体的干扰,方法是将气体先通过足量的酸性KMnO4溶液,再通过澄清石灰水,若石灰水变浑浊,则存在CO2,若不变浑浊,则不存在CO2,
答案为:将气体先通过足量的酸性KMnO4溶液,再通过澄清石灰水,若石灰水变浑浊,则存在CO2,若不变浑浊,则不存在CO2。
⑸由质量分数为10%的Na2SO3溶液加热浓缩溶液至有大量晶体析出,由图象可知在高于34℃条件下趁热过滤,可得到无水Na2SO3。
答案为:加热浓缩溶液至有大量晶体析出,由图象可知在高于34℃条件下趁热过滤。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】关于下图所示原电池装置的说法错误的是( )
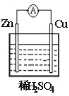
A.Zn为负极,反应为Zn-2e-=Zn2+B.铜棒上发生还原反应
C.电子从锌片经导线流向铜片D.溶液中氢离子浓度保持不变,溶液中SO42-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了验证 Fe2+与 Cu2+氧化性强弱,下列装置能达到实验目的的是_______(填装置序号), 其正极的电极反应式为_______;若构建该原电池时两个电极的质量相等,当导线中通过 0.4 mol 电子时,两个电极的质量差为_______g。
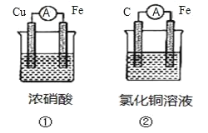
(2)将 CH4 设计成燃料电池,其利用率更高,装置如图所示(A、B 为多孔碳棒)。

实验测得 OH- 定向移向 A 电极,则_______(填 A 或 B)处电极入口通 CH4,其电极反应式为_______。
(3)金属冶炼和处理常涉及氧化还原反应。由下列物质冶炼相应金属时采用电解法的是_______(填选 项字母)。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)![]() Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-
Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-![]() [Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
[Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
A. 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀
B. 当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点
C. 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+
D. 滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种高效、广谱、安全的杀菌、消毒剂,易溶于水。制备方法如下:
(1)步骤Ⅰ:电解食盐水制备氯酸钠。用于电解的食盐水需先除去其中的 Ca2+、Mg2+、SO42-等杂质。在除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的________和NaOH,充分反应后将沉淀一并滤去。
(2)步骤Ⅱ:将步骤Ⅰ得到的食盐水在特定条件下电解得到氯酸钠(NaClO3),再将它与盐酸反应生成ClO2与Cl2,ClO2与Cl2的物质的量比是____________。
(3)学生拟用左下图所示装置模拟工业制取并收集ClO2,用NaClO3和草酸(H2C2O4)恒温在60℃ 时反应制得。

反应过程中需要对A容器进行加热,加热的方式为____________;加热需要的玻璃仪器除酒精灯外,还有_________________;
(4)反应后在装置C中可得亚氯酸钠(NaClO2)溶液。已知NaClO2饱和溶液在温度低于38℃时,析出的晶体是NaClO2·3H2O,在温度高于38℃时析出的是NaClO2。根据右上图所示NaClO2的溶解度曲线,请完成从NaClO2溶液中制得NaClO2·3H2O的操作步骤:
①_____________;②_______________;③洗涤;④干燥。
(5)目前我国已成功研制出利用NaClO2制取二氧化氯的新方法,将Cl2通入到NaClO2溶液中。现制取270kg二氧化氯,需要亚氯酸钠的质量是________。
(6)ClO2和Cl2均能将电镀废水中的剧毒CN-氧化为无毒物质,自身被还原为Cl-。处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的_______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电化学装置能达到目的的是

A.图甲:制取少量Fe(OH)2
B.图乙:证明铁发生了析氢腐蚀
C.图丙:在铁表面镀锌
D.图丁:实现原电池反应Cu+2Fe3+=Cu2++2Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解法无害化处理水体中的NO3-,最终生成N2逸出。其装置及转化如图所示。列说法正确的是

A.N电极为电源的负极
B.电解池工作时Na+移向电极Ⅱ
C.电极Ⅰ的电极反应:NO3-+8e+10H+=NH4++3H2O
D.电解池工作时电极Ⅰ产生的NH4+被电极Ⅱ产生的HClO氧化为N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 用银氨溶液检验乙醛中的醛基:CH3CHO + 2Ag(NH3)2+ +2OH-![]() CH3COONH4 + 3NH3 + 2Ag↓+ H2O
CH3COONH4 + 3NH3 + 2Ag↓+ H2O
B. 苯酚钠溶液中通入少量CO2:CO2+ H2O + 2C6H5O-→ 2C6H5OH + CO32-
C. 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+ Ag+ =AgCl↓
D. 硫酸铝溶液中加入过量的氨水:Al3+ + 3NH3·H2O=Al(OH)3↓ + 3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li2O是离子晶体,从如图的BornHaber循环可得出Li2O晶格能为 ( )
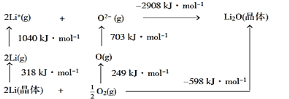
A. 598kJ·mol1B. -598KJ·mol1C. 1168kJ·mol1D. 2908kJ·mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com