
| A. | CuH与稀盐酸反应的化学方程式为2CuH+2HCl═CuCl2+2H2↑+Cu | |
| B. | CuH在足量氯气中燃烧的化学方程式为2CuH+Cl2═2Cu+2HCl | |
| C. | CuH在稀硝酸反应的化学方程式为CuH+3HNO3═Cu(NO3)2+NO↑+2H2O | |
| D. | CuH受热分解的化学方程式为2CuH═2Cu+H2↑ |
分析 A、Cu+在酸性条件下发生反应2Cu+═Cu2++Cu,+1价的铜在酸性条件下生成单质铜和铜离子,-1价的氢与+1价的氢发生归中反应生成氢气;
B、氯气具有强氧化性,能将亚铜氧化成+2价的铜;
C、硝酸是强氧化性的酸,与CuH发生氧化还原反应;
D、CuH不稳定受热易分解,发生自身的氧化还原反应.
解答 解:A、Cu+在酸性条件下发生反应2Cu+═Cu2++Cu,+1价的铜在酸性条件下生成单质铜和铜离子,-1价的氢与+1价的氢发生归中反应生成氢气,所以CuH与稀盐酸反应的化学方程式为2CuH+2HCl═CuCl2+2H2↑+Cu,故A正确;
B、氯气具有强氧化性,能将亚铜氧化成+2价的铜,所以反应的化学方程式为:2CuH+3Cl2═2CuCl2+2HCl,故B错误;
C、硝酸是强氧化性的酸,与CuH发生氧化还原反应,所以反应的化学方程式为:CuH+3HNO3═Cu(NO3)2+NO↑+2H2O,故C正确;
D、CuH不稳定受热易分解,发生自身的氧化还原反应,反应的化学方程式为:2CuH═2Cu+H2↑,故D正确;
故选B.
点评 本题考查氧化还原反应的知识,是信息给予题,筛选有用信息结合已学知识进行整合处理,比较容易.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 价格便宜,不易生锈 | |
| B. | 铁锅只含有铁元素 | |
| C. | 烹调的食物中留有人体需要的铁元素 | |
| D. | 传热慢,保温性能好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
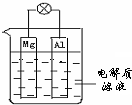 如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
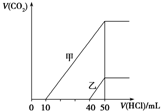
| A. | 原NaOH溶液的物质的量浓度为0.5 mol•L-1 | |
| B. | 当0<V(HCl)<10 mL时,甲溶液中发生反应的离子方程式为:OH-+H+═H2O | |
| C. | 乙溶液中含有的溶质是NaOH、NaHCO3 | |
| D. | 乙溶液中滴加盐酸后产生CO2体积的最大值为112 mL(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中只有一种阴离子(OH-除外) | B. | 溶液中溶质的物质的量之比为1:2 | ||
| C. | 反应后有CO2逸出 | D. | 反应后的溶液还可以吸收部分CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的导热性能较好,应大力提倡用铝炊具 | |
| B. | 铝制器具不宜盛放食品较长时间(如放入冰箱中过夜等) | |
| C. | 明矾可用于饮用水的杀菌消毒 | |
| D. | 小孩可以食用含铝较多的食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH固体 | B. | NH4Cl固体 | C. | NaNO3固体 | D. | CH3COONa固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
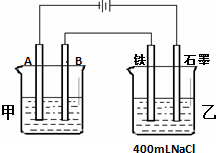 如图所示为相互串联的甲、乙两个电解池,试回答:
如图所示为相互串联的甲、乙两个电解池,试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com