
| 实验操作及现象 | 实验结论 | |
| A | 在0.1mol/L的Na2CO3溶液中,加2滴酚酞显浅红色,微热,溶液颜色加深 | Na2CO3水解是吸热反应 |
| B | 向2mL0.1mol/LNaOH溶液中滴加3滴0.1mol/LMgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol/LFeCl3溶液,出现红褐色沉淀 | 溶解度: Mg(OH)2>Fe(OH)3 |
| C | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性:H2O2比Fe3+强 |
| D | 用3mL稀H2SO4溶液与足量Zn反应,当气泡稀少时,加入1mL浓H2SO4,又迅速产生较多气泡 | H2SO4浓度增大,反应速率加快 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.微热促进碳酸根离子的水解,碱性增强,且溶液颜色加深;
B.NaOH过量,均为沉淀的生成;
C.酸性条件下,硝酸根离子与亚铁离子可发生氧化还原反应;
D.浓硫酸的加入,放出热量,导致溶液的温度升高.
解答 解:A.碳酸根离子水解显碱性,遇酚酞变红,微热促进碳酸根离子的水解,碱性增强,且溶液颜色加深,则操作、现象、结论均合理,故A正确;
B.NaOH过量,均为沉淀的生成,不发生沉淀的转化,则不能比较Mg(OH)2、Fe(OH)3的溶解度,故B错误;
C.酸性条件下,硝酸根离子与亚铁离子可发生氧化还原反应,则不能判定是否发生过氧化氢与亚铁离子的反应,结论不合理,故C错误;
D.浓硫酸的加入,放出热量,导致溶液的温度升高,则温度、浓度均可加快反应速率,结论不合理,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握水解、沉淀的生成和转化、氧化还原反应、反应速率的影响因素等为解答的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合、实验评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 可在分液漏斗内用四氯化碳萃取碘酒中的碘单质 | |
| B. | 分液漏斗在使用前只需检查旋塞芯处是否漏水即可 | |
| C. | 放出下层液体时,应打开上方的玻璃塞,并使下端管口紧贴烧杯内壁 | |
| D. | 放出下层液体后,再从漏斗下端口放出上层液体. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
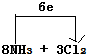 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 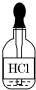 | B. | 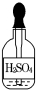 | C. |  | D. | 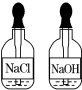 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
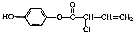 ,有关M下列叙述中正确的是( )
,有关M下列叙述中正确的是( )| A. | 可与H2反应,1mol M最多消耗5mol H2 | |
| B. | 可与浓溴水反应,1mol M最多消耗4mol Br2 | |
| C. | 可与NaOH溶液反应,1mol M最多消耗4mol NaOH | |
| D. | 常温下,M在水中的溶解度大于苯酚在水中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6mol H2和2mol N2 | |
| B. | 2mol NH3和1mol N2 | |
| C. | 2mol N2和3mol H2 | |
| D. | 0.1mol NH3、0.95mol N2、2.85mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
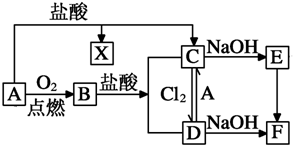
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3 | B. | (NH4)2CO3 | C. | (NH4)2SO4 | D. | (NH4)2SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com