
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种,取该溶液进行实验,实验内容如下:
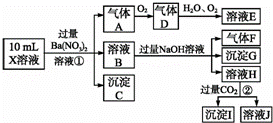
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是 ﹣;不能确定是否含有的离子是 ,若要确定其中阳离子的存在,最可靠的化学方法是 +.
(2)沉淀G的化学式为
(3)写出有关离子方程式:步骤①中生成A .步骤②生成沉淀I ﹣.
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,当沉淀C物质的量(填:“<”或“=”或“>”某个值) 0.7(或<0.7) mol,表明不能确定是否含有的离子中一定存在 .(若不止一种可能,填一种情况即可)
考点: 常见离子的检验方法.
分析: 在强酸性溶液中一定不会存在CO32﹣和SO32﹣离子;加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42﹣离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3﹣离子,含有SO42﹣离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl﹣,据此进行解答.
解答: 解:(1)在强酸性溶液中一定不会存在CO32﹣和SO32﹣离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42﹣离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3﹣离子,含有SO42﹣离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl﹣,检验Fe3+的方法为:取少量X溶液放在试管中,加入几滴KSCN,溶液不变红色说明无Fe3+,
故答案为:Al3+、NH4+、Fe2+、SO42﹣; Cl﹣、Fe3+;取少量X溶液放入试管中,加入几滴KSCN溶液,溶液不变红色说明无Fe3+,若变红则说明含Fe3+;
(2)Fe2+离子被氧化为Fe3+离子,加入NaOH溶液后生成Fe(OH)3,故答案为:Fe(OH)3;
(3)①Fe2+离子被氧化为Fe3+离子,反应的离子方程式为:3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O,②沉淀I为氢氧化铝,偏铝酸钠与过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢根离子,反应的离子方程式为:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣,
故答案为:3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O;AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣;
(4)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O,可知Fe2+物质的量为0.03mol; 碳溶液中正电荷为:2n(Fe2+)+3n(Al3+)+n(NH4+)+n(H+)=2×0.03mol+3×0.01mol+0.01mol+0.04mol=0.14mol;沉淀C为硫酸钡,若没有其它离子,根据电荷守恒,硫酸根离子的物质的量为: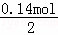 =0.07mol,生成硫酸钡的物质的量为0.07mol,所以当硫酸钡沉淀的物质的量>0.07mol时,溶液中一定存在Fe3+,当硫酸钡的物质的量=0.07mol时Fe3+、Cl﹣都不存在,当硫酸钡的物质的量<0.07mol时,溶液中一定存在Cl﹣,
=0.07mol,生成硫酸钡的物质的量为0.07mol,所以当硫酸钡沉淀的物质的量>0.07mol时,溶液中一定存在Fe3+,当硫酸钡的物质的量=0.07mol时Fe3+、Cl﹣都不存在,当硫酸钡的物质的量<0.07mol时,溶液中一定存在Cl﹣,
故答案为:>0.7(或<0.7);Fe3+(或Cl﹣).
点评: 本题考查物质的检验与鉴别,属于中等难度的试题,试题综合性强,难度较大,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率,要依据物质的特殊性质和特征反应来判断、推理、验证.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
根据下表信息,下列叙述中正确的是()
序号 氧化剂 还原剂 氧化产物 还原产物
① Cl2 FeBr2 FeCl3
② KMnO4 H2O2 O2 MnO2
③ KClO3 浓盐酸 Cl2
④ KMnO4 浓盐酸 Cl2 MnCl2
A. 表中①反应的氧化产物只能有FeCl3
B. 表中②生成1mol的O2将有4mol的电子转移
C. 表中④的离子方程式配平后,H+的化学计量数为16
D. 表中③还原产物是KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍.则下列判断正确的是()
A. 两种单质的摩尔质量比为1:4
B. 生成物C中A的质量分数为75%
C. 生成物C中A、B的原子个数比为3:1
D. 反应前后气体分子数比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 1.0L 1.0mo1•L﹣1的NaAlO2水溶液中含有的氧原子数为2NA
B. 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
C. 25℃时pH=13的NaOH溶液中含有OH﹣的数目为0.1NA
D. 1mol的羟基与1moL的氢氧根离子所含电子数均为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 使甲基橙变红色的溶液:Mg2+、K+、SO42﹣、NO3﹣
B. 使酚酞变红色的溶液:Na+、Cu2+、HCO3﹣、NO3﹣
C. 0.1 mol•L﹣1AgNO3溶液:H+、K+、SO42﹣、I﹣
D. 0.1 mol•L﹣1NaAlO2溶液:H+、Na+、Cl﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
矿泉水是人们居家旅游常用的饮料,市场上有些不法商贩为牟取暴利,用自来水(用氯气消毒)冒充矿泉水出售.为辨别真伪,可用下列的一种化学试剂来鉴别,该试剂是( )
A. 酚酞试液 B. 氯化钡溶液 C. 氢氧化钠溶液 D. 硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃结构简式如下: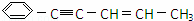 ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )
A. 所有原子可能在同一平面上
B. 所有原子可能在同一条直线上
C. 所有碳原子可能在同一平面上
D. 所有碳原子可能在同一直线上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com