
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究,将质量相同的粉末状和块状的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据。
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:______。该反应是______(填“放热”或“吸热”)反应。
(2)实验结果表明,催化剂的催化效果与____有关。
(3)某同学在10 mLH2O2溶液中加入一定量的MnO2,放出气体的体积(标准状况)与反应时间的关系如下图所示,则A、B、C三点所表示的反应速率最慢的是____。

Ⅱ.某反应在体积为5 L的恒容密闭容器中进行,在0~3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体)。

(4)该反应的化学方程式为____。
(5)反应开始至2分钟时,B的平均反应速率为_____,A的转化率为______。
【答案】2H2O2![]() 2H2O +O2↑ 放热 催化剂接触面积的大小 C 2A+B
2H2O +O2↑ 放热 催化剂接触面积的大小 C 2A+B![]() 2C 0.1 mol/(L·min) 40%
2C 0.1 mol/(L·min) 40%
【解析】
Ⅰ.(1)二氧化锰是过氧化氢分解的催化剂,由带火星木条复燃,可知产物,由此可写出方程式,反应发生后溶液温度升高,说明反应为放热反应;
(2)由实验现象可知催化剂作用大小的影响因素;
(3)A、B、C三点的斜率代表反应速率,斜率越大,反应速率越大;
Ⅱ.(4)从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程;
(5)化学反应速率是单位时间内浓度的变化,据此可求得反应速率;利用转化率等于转化量与起始量的比值计算物质的平衡转化率。
I.(1)上述实验中发生反应的化学方程式为:2H2O2![]() 2H2O +O2↑,反应发生后物质温度升高,说明H2O2的分解反应为放热反应;
2H2O +O2↑,反应发生后物质温度升高,说明H2O2的分解反应为放热反应;
(2)反应时间少,则反应速率快,实验结果表明,催化剂的催化效果与催化剂的表面积有关;
(3)由图可知,曲线斜率变小,反应速率减小,则A、B、C三点所表示的反应速率最慢的是C;
Ⅱ.(4)由图象可知:A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,则C为生成物,当反应到达2 min时,△n(A)=2 mol,△n(B)=1 mol,△n(C)=2 mol,在化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,2 min后外界条件不变,三种物质都存在,且各种物质的物质的量都不发生变化,说明该反应为可逆反应,故反应的化学方程式为:2A+B![]() 2C;
2C;
(5)由图象可以看出,反应开始至2分钟时,△n(B)=1 mol,B的平均反应速率v(B)=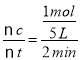 =0.1 mol/(L·min);2 min内A改变的物质的量为△n(A)=2 mol,反应开始时A物质的量是5 mol,所以A的反应转化率为
=0.1 mol/(L·min);2 min内A改变的物质的量为△n(A)=2 mol,反应开始时A物质的量是5 mol,所以A的反应转化率为![]() ×100%=40%。
×100%=40%。


科目:高中化学 来源: 题型:
【题目】实验室用下图所示的装置制取乙酸乙酯
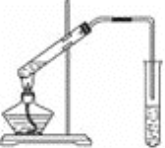
(1)在大试管中加入碎瓷片然后配制一定比例的乙醇、乙酸和浓硫酸的混合液,然后轻轻振荡试管使之混合均匀,加入碎瓷片的目的的________。
(2)装置中通蒸气的导管要插在饱和的Na2CO3溶液的液面上而不能插入溶液中,目的是____________。
(3)图中右边试管中试剂是_________________。作用是①__________________②_______________________________③____________________________。
(4)分离得到乙酸乙酯的方法是____________,分离需要的玻璃仪器是______________________。
(5)写出制乙酸乙酯的方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
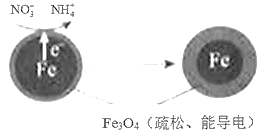
①作负极的物质是____。
②正极的电极反应式是____。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是____。
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在家期间设计了如下实验验证家中常见的两种有机物性质,请根据题目要求填写下列空格:
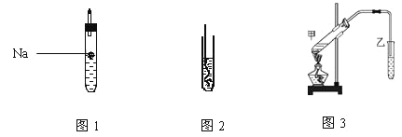
(1)如图1所示,试管中装乙醇产生反应的方程式_____ ,该反应类型为____ ;
(2)如图2所示,螺旋状的铜丝加热后可以铜丝表面变成______色,插入到装有乙醇的试管中铜丝表面又变成___色,并闻到有刺激性气味,该物质的结构简式为__;
(3)将鸡蛋放入食醋中看到鸡蛋表面有气泡生成,说明醋酸的酸性_____碳酸的酸性。(填“强于”或“弱于”)
(4)按如图3所示装置,甲试管中装有乙酸、乙醇、浓硫酸还需要加入____,目的是_______;加热时发生的反应方程式为__________,一段时间后在装有饱和碳酸钠溶液的乙试管______(填“上方”或“下方”)可以看到油状物质并闻到有特殊香味,分离该物质的实验操作是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组查阅资料得知:保险粉(Na2S2O4)和KOH的混合溶液能定量吸收O2;CuCl的盐酸溶液能定量吸收CO,且易被O2氧化。拟设计实验方案,采用上述两种溶液和KOH溶液及量气装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。下列说法不正确的是( )
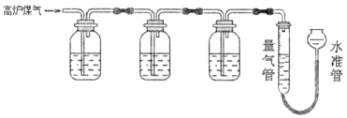
A.采用上述3种吸收剂,气体被逐一吸收的顺序应该是CO2、O2和CO
B.保险粉(Na2S2O4)和KOH的混合溶液吸收O2的离子方程式为2S2O42-+3O2+4OH-=4SO42-+2H2O
C.当三种气体被逐一吸收后,导出的气体中可能含有HCl
D.其他两种吸收剂不变,O2的吸收剂可以用灼热的铜网替代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中制取高纯碳酸钴(CoCO3)的工艺流程如图:
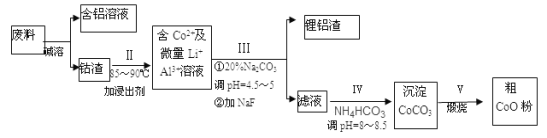
(1)写出一条加快碱溶速率的措施__。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的离子反应方程式为__(产物中只有一种酸根)。该过程不能用盐酸代替硫酸进行酸化,原因是_。
(3)过程Ⅲ中碳酸钠溶液的作用是沉淀Al3+和Li+,写出沉淀Al3+的离子方程式__。
(4)过程Ⅳ沉钴的离子方程式是__。
(5)CoCO3可用于制备锂离子电池的正极材料LiCoO2,其生产工艺是将n(Li):n(Co)=l:l的Li2CO3和CoCO3的固体混合物在空气中加热至700℃~900℃。试写出该反应的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物分子结构式如下图,下列说法正确的是( )
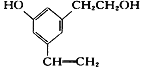
A. 取少量该有机物,滴加酸性高锰酸钾溶液,微热,有气体产生
B. 所有的碳原子不可能处在同一个平面上
C. 所有的氧原子不可能同时处在苯环平面上
D. 所有的氢原子有可能同时处在苯环平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制500mL0.2mol/LNaOH溶液,实验操作步骤为:
A.把制得的溶液小心地转移至容量瓶中。
B.在天平上称取 g的氢氧化钠钠固体,把它放在烧杯中,用适量的蒸馏水将它完全溶解并冷却至室温。
C.继续向容量瓶中加蒸馏水至 ,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为___(填序号)。
(2)题目B、C项空白处填入。___、___。
(3)本实验用到的基本仪器已有烧杯、天平(砝码、镊子)、玻璃棒,还缺少的必要仪器是___。
(4)下列情况中,会使所配溶液浓度偏高的是___(填序号)。
A.没有冷却直接移液
B.没有进行上述的操作步骤D
C.加蒸馏水时,不慎超过了刻度线
D.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国庆70周年阅兵式展示了我国研制的各种导弹。导弹之所以有神奇的命中率,与材料息息相关,镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物(如砷化镓、磷化镓等)都是常用的半导体材料。回答下列问题:
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为[Ar]__。
(2)根据元素周期律,原子半径Ga__As,第一电离能Ga__As。(填“大于”或“小于”)
(3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是__。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因:__。
晶体 | GaN | GaP | GaAs |
熔点/℃ | 1700 | 1480 | 1238 |
(5)GaN晶胞的结构如图1所示。已知六棱柱底边边长为acm,阿伏加德罗常数的值为NA。
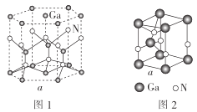
①晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为__。
②从GaN晶体中“分割”出的平行六面体如图2。若该平行六面体的体积为![]() a3cm3,则GaN晶体的密度为__(用含a、NA的代数式表示)g·cm-3。
a3cm3,则GaN晶体的密度为__(用含a、NA的代数式表示)g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com