
【题目】实验室用下图所示的装置制取乙酸乙酯
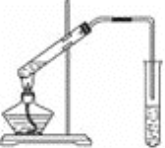
(1)在大试管中加入碎瓷片然后配制一定比例的乙醇、乙酸和浓硫酸的混合液,然后轻轻振荡试管使之混合均匀,加入碎瓷片的目的的________。
(2)装置中通蒸气的导管要插在饱和的Na2CO3溶液的液面上而不能插入溶液中,目的是____________。
(3)图中右边试管中试剂是_________________。作用是①__________________②_______________________________③____________________________。
(4)分离得到乙酸乙酯的方法是____________,分离需要的玻璃仪器是______________________。
(5)写出制乙酸乙酯的方程式____________________________________。
【答案】防止暴沸 防止倒吸 饱和碳酸钠溶液 溶解乙醇 中和乙酸 降低乙酸乙酯的溶解度,便于分层析出 分液 分液漏斗、烧杯 CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
【解析】
此题是对乙酸乙酯制备的基础考查,根据反应原理即可作答,饱和碳酸钠的作用有三条,要考虑左边试管加热,挥发出来的乙醇和乙酸对于收集乙酸乙酯纯度的干扰,从而确定其作用。
(1)加热混合液体时,为防止暴沸,通常加入沸石或碎瓷片,故加入碎瓷片的目的是防止暴沸;
(2)由于挥发出的乙醇和乙酸易溶于水,溶于水后导管内压强减小,从而引起倒吸,故通蒸气的导管不能插入溶液中,目的是防止倒吸;
(3)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,故右边试管中试剂是饱和碳酸钠溶液,其主要作用为吸收乙醇,除去乙酸,降低乙酸乙酯的溶解度、便于分层,然后分液即可分离,故答案为:溶解乙醇、中和乙酸、降低乙酸乙酯的溶解度,便于分层析出;
(4)乙酸乙酯不溶于水,加饱和碳酸钠溶液振荡、静置后,与乙酸乙酯分层,则要把制得的乙酸乙酯分离出来,应采用的实验操作是分液,分液需要的玻璃仪器是分液漏斗和烧杯;
(5)制乙酸乙酯的方程式为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O。
CH3COOC2H5+H2O。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,则下列说法中,正确的是( )
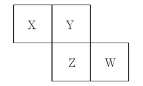
A.原子半径:W>Z>Y>X
B.形成氢化物的稳定性:Z>W
C.常温下:X、Y、Z、W形成的常见单质均为气态
D.W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积不变的密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
A.N2、H2、NH3的浓度之比为1∶3∶2
B.混合气体的密度不随时间变化
C.当有1molN≡N键断裂时,有6molN—H键断裂
D.单位时间内生成2amolNH3,同时消耗amolN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为__________。
(2) CH3COOH中碳原子的杂化形式为________。
(3) NO3-的空间构型是①______,与NO3-互为等电子体的分子的化学式为②______(任写一种)。
(4) CH3COOH能与H2O以任意比互溶的原因是____________________。
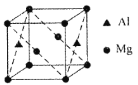
(5)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,该合金的化学式为①_______,晶体中每个镁原子周围距离最近的铝原子数目为②_______,该晶体的密度为③______g/cm3(阿伏伽德罗常数的数值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,取下列四种有机物各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是
A. C2H5OH B. CH4 C. C2H4O D. C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料,可替代氟氯代烷作制冷剂,利用水煤气合成二甲醚的三步反应如下:
2H2(g)+CO(g)=CH3OH(g) ΔH=-90.8 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.3 kJ·mol-1
请回答下列问题。
(1)由 H2和CO直接制备二甲醚的总反应:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的ΔH=________。一定条件下的密闭容器中,该总反应达到平衡,要提高CO的平衡转化率,可以采取的措施有________(填字母代号)。
a.高温高压 b.加入催化剂 c.分离出CO2
d.增加CO的量 e.分离出二甲醚
(2)某温度下反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v正___(填“>”“<”或“=”)v逆。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=________,该时间段内v(CH3OH)=________。
(3)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0 MPa的条件下,在相同时间内测得CH3OCH3产率随温度变化的曲线如图甲所示。其中CH3OCH3产率随温度升高而降低的原因可能是_____________________________________。

(4)二甲醚直接燃料电池具有启动快、效率高、能量密度高等优点,可用于电化学降解治理水中硝酸盐的污染。电化学降解NO3-的原理如图乙所示。若电解质为酸性,二甲醚直接燃料电池的负极反应式为____________________;若电解过程中转移了2 mol电子,则阳极室减少的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维拉帕米(又名异搏定)是治疗心绞痛和原发性高血压的药物,合成路线中某一步骤如图所示,下列说法中正确的是
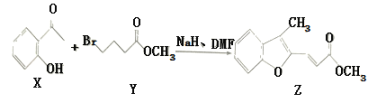
A. Y的分子式为C5H11O2 Br
B. 含苯环和羧基的ⅹ的同分异构体有4种
C. 可以用酸性高锰酸钾溶液鉴别X和Z
D. 1mol Z最多可与6mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.对金属制品进行抗腐蚀处理,可延长其使用寿命。
以下为铝材表面处理的一种方法:
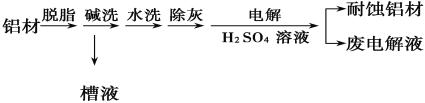
碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,其原因是__________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的_____。
A.NH3 B.CO2 C.NaOH D.HNO3
Ⅱ.某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现下图所示的物质之间的转化:
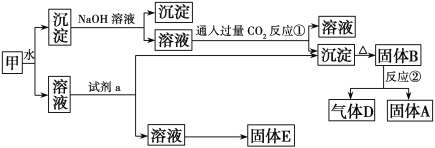
(1)试剂a最好选用________(选填A、B、C、D)。
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
(2)写出反应①的离子方程式:___________________________________。
(3)反应②的化学方程式为:____________________________________。
(4) 反应①结束后进行的操作是________________________
(5)固体E可以作为复合性的化学肥料,E中所含物质的化学式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究,将质量相同的粉末状和块状的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据。
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:______。该反应是______(填“放热”或“吸热”)反应。
(2)实验结果表明,催化剂的催化效果与____有关。
(3)某同学在10 mLH2O2溶液中加入一定量的MnO2,放出气体的体积(标准状况)与反应时间的关系如下图所示,则A、B、C三点所表示的反应速率最慢的是____。

Ⅱ.某反应在体积为5 L的恒容密闭容器中进行,在0~3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体)。

(4)该反应的化学方程式为____。
(5)反应开始至2分钟时,B的平均反应速率为_____,A的转化率为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com