
【题目】Ⅰ.对金属制品进行抗腐蚀处理,可延长其使用寿命。
以下为铝材表面处理的一种方法:
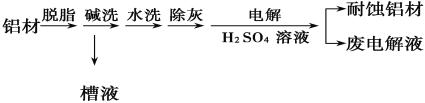
碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,其原因是__________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的_____。
A.NH3 B.CO2 C.NaOH D.HNO3
Ⅱ.某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现下图所示的物质之间的转化:
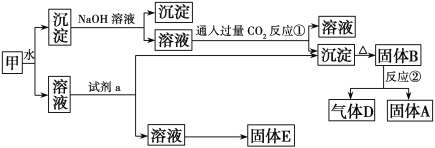
(1)试剂a最好选用________(选填A、B、C、D)。
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
(2)写出反应①的离子方程式:___________________________________。
(3)反应②的化学方程式为:____________________________________。
(4) 反应①结束后进行的操作是________________________
(5)固体E可以作为复合性的化学肥料,E中所含物质的化学式为________.
【答案】2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ B D [Al(OH)4]-+CO2=Al(OH)3↓+HCO![]() 2Al2O3(熔融)
2Al2O3(熔融)![]() 4Al+3O2↑ 过滤 (NH4)2SO4、K2SO4
4Al+3O2↑ 过滤 (NH4)2SO4、K2SO4
【解析】
Ⅰ.铝容易被氧气氧化形成致密的氧化膜,碱洗时氧化铝转化为偏铝酸根进入溶液,为防止损失将其转化为氢氧化铝沉淀,需引入弱酸,同时铝暴露出来与碱液反应生成氢气,产生气泡;II.由甲的成分知加水溶解后,溶液中是KAl(SO4)2 ,沉淀是Al2O3 和Fe2O3 。
向沉淀中加 NaOH 溶液,Fe2O3 不反应,Al2O3 可与 NaOH 溶液反应生成NaAlO2 ,向NaAlO2溶液中通入过量CO2 可得Al(OH)3 沉淀和碳酸氢钠,Al(OH) 3 受热分解生成 B 为Al2O3 ,电解熔融氧化铝 B 得到气体 D 为O2 ,固体 A 为 Al ;向溶液中加过量氨水,溶液与过量氨水反应,Al3+ 被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4 )2SO4 ,经过蒸发、结晶,得到的是K2SO4 和(NH4)2SO4 。
I.铝材碱洗可以洗去表面的氧化铝,裸露的铝会和碱溶液反应放出氢气,2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑,故碱洗时常有气泡冒出;
氢氧化铝是两性氢氧化物,可溶于强酸强碱,因此,碱洗槽液中的偏铝酸根,应通入CO2使其沉淀成氢氧化铝,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解,故答案为B;
II. (1)依据流程分析,向溶液中加入的试剂 a 作用是沉淀铝离子,应向溶液中加过量氨水,溶液与过量氨水反应,Al3+ 被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4 ,经过蒸发、结晶,得到的是K2SO4 和(NH4)2SO4 ,故答案为 D ;
(2)反应 ① 中二氧化碳过量,反应生成沉淀和碳酸氢钠,向NaAlO2 溶液中通入过量CO2 可得Al(OH)3 沉淀和碳酸氢钠,离子方程式为[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-;
(3)反应②为Al2O3分解得到铝和氧气,化学方程式为2Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;
(4)反应①得到溶液和沉淀,二者分离采用过滤的方法,故进行的操作是过滤;
(5)由上面的分析可知,E中所含物质的化学式为(NH4)2SO4、K2SO4。


科目:高中化学 来源: 题型:
【题目】反应2SO3(g)![]() 2SO2(g) + O2(g)的能量与反应进程如图(a) 所示;在恒容密闭容器中充入SO3(g),T1°C测得其中的SO3(g)和O2(g)的浓度随时间变化如图(b) 所示。下列说法正确的是
2SO2(g) + O2(g)的能量与反应进程如图(a) 所示;在恒容密闭容器中充入SO3(g),T1°C测得其中的SO3(g)和O2(g)的浓度随时间变化如图(b) 所示。下列说法正确的是
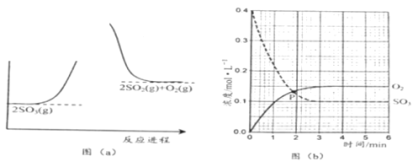
A.由图(a) 知,正反应为放热反应
B.图(b)中,SO3分解的平均速率0~1min比1~2min慢
C.图(b)中,P点时反应达到平衡状态
D.由图(b)知,SO2的平衡浓度为0.3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示的装置制取乙酸乙酯
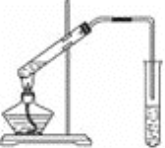
(1)在大试管中加入碎瓷片然后配制一定比例的乙醇、乙酸和浓硫酸的混合液,然后轻轻振荡试管使之混合均匀,加入碎瓷片的目的的________。
(2)装置中通蒸气的导管要插在饱和的Na2CO3溶液的液面上而不能插入溶液中,目的是____________。
(3)图中右边试管中试剂是_________________。作用是①__________________②_______________________________③____________________________。
(4)分离得到乙酸乙酯的方法是____________,分离需要的玻璃仪器是______________________。
(5)写出制乙酸乙酯的方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子化合物R的结构简式如图,下列有关R的说法正确的是

A. R的单体之一的分子式为C9H12O2
B. R可通过加聚和缩聚反应合成,R完全水解后生成2种产物
C. R是一种有特殊香味,难溶于水的物质
D. 碱性条件下,1 mol R完全水解消耗NaOH的物质 的量为n(m+1)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
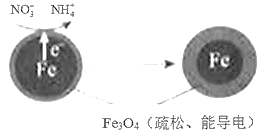
①作负极的物质是____。
②正极的电极反应式是____。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是____。
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在家期间设计了如下实验验证家中常见的两种有机物性质,请根据题目要求填写下列空格:
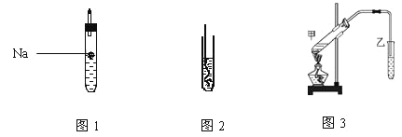
(1)如图1所示,试管中装乙醇产生反应的方程式_____ ,该反应类型为____ ;
(2)如图2所示,螺旋状的铜丝加热后可以铜丝表面变成______色,插入到装有乙醇的试管中铜丝表面又变成___色,并闻到有刺激性气味,该物质的结构简式为__;
(3)将鸡蛋放入食醋中看到鸡蛋表面有气泡生成,说明醋酸的酸性_____碳酸的酸性。(填“强于”或“弱于”)
(4)按如图3所示装置,甲试管中装有乙酸、乙醇、浓硫酸还需要加入____,目的是_______;加热时发生的反应方程式为__________,一段时间后在装有饱和碳酸钠溶液的乙试管______(填“上方”或“下方”)可以看到油状物质并闻到有特殊香味,分离该物质的实验操作是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制500mL0.2mol/LNaOH溶液,实验操作步骤为:
A.把制得的溶液小心地转移至容量瓶中。
B.在天平上称取 g的氢氧化钠钠固体,把它放在烧杯中,用适量的蒸馏水将它完全溶解并冷却至室温。
C.继续向容量瓶中加蒸馏水至 ,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为___(填序号)。
(2)题目B、C项空白处填入。___、___。
(3)本实验用到的基本仪器已有烧杯、天平(砝码、镊子)、玻璃棒,还缺少的必要仪器是___。
(4)下列情况中,会使所配溶液浓度偏高的是___(填序号)。
A.没有冷却直接移液
B.没有进行上述的操作步骤D
C.加蒸馏水时,不慎超过了刻度线
D.容量瓶使用前内壁沾有水珠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com