
 3HF (����ӦΪ���ȷ�Ӧ)
3HF (����ӦΪ���ȷ�Ӧ) 2HF (����ӦΪ���ȷ�Ӧ)
2HF (����ӦΪ���ȷ�Ӧ)| A���������ƽ��Ħ������Ϊ40 g/mol����H3F3�������������Ϊ10% |
| B�����ڶ��¶������ٳ���H3F3����H3F3��HF��Ũ��(mol/L)��ֵ���� |
| C���������ƽ��Ħ������Ϊ42 g/mol����H3F3�����������С��10% |
| D�����ڶ��¶����ٳ���HF����H3F3��HF��Ũ��(mol/L)��ֵ���� |
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
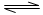 2C��g�� ��2���ӷ�Ӧ�ﵽƽ�⣬��ʱ����0.2mol C��
2C��g�� ��2���ӷ�Ӧ�ﵽƽ�⣬��ʱ����0.2mol C��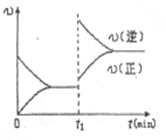
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3����һ���������Ѵﵽƽ��״̬��
2NH3����һ���������Ѵﵽƽ��״̬���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
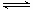 p C(g)����H = a kJ/mol ( a<0)�����ں��¡������´ﵽƽ��ʱA��ת����ΪA1% ���ھ��ȡ����������´ﵽƽ��ʱA��ת����ΪA2%����A1��A2�Ĺ�ϵΪ
p C(g)����H = a kJ/mol ( a<0)�����ں��¡������´ﵽƽ��ʱA��ת����ΪA1% ���ھ��ȡ����������´ﵽƽ��ʱA��ת����ΪA2%����A1��A2�Ĺ�ϵΪ| A��A1<A2 | B��A1=A2 |
| C��A1>A2 | D������ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
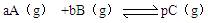 ��H=������Ӧ�����¼���±���
��H=������Ӧ�����¼���±���| ʱ�� | c��A��/mol  L-1 L-1 | c��B��/mol L-1 | c��C��/mol L-1 |
| 0min | 1 | 3 | 0 |
��2m in in | 0.8 | 2.6 | 0.4 |
| ��4min | 0.4 | 1.8 | 1.2 |
| ��6min | 0.4 | 1.8 | 1.2 |
| ��8min | 0.1 | 2.0 | 1.8 |
| ��9min | 0.05 | 1.9 | 0.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Z(g)��2W(g)����ƽ��ʱ,A�����Ϊ1.2aL������˵����ȷ����
Z(g)��2W(g)����ƽ��ʱ,A�����Ϊ1.2aL������˵����ȷ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 xC(g)��2minʱ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩��ʣ����0.8molB�������C��Ũ��Ϊ0.4mol��L������д���пհף�
xC(g)��2minʱ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩��ʣ����0.8molB�������C��Ũ��Ϊ0.4mol��L������д���пհף��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
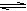 2SO3(g)���������������ٱ仯ʱ������˵����ѧ��Ӧ�Ѿ��ﵽƽ��״̬����
2SO3(g)���������������ٱ仯ʱ������˵����ѧ��Ӧ�Ѿ��ﵽƽ��״̬����| A���������������ʵ��� | B������������ѹǿ |
| C��SO2��ת���� | D�����������ܶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
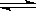 nC(g)+2D(g) ���ﵽƽ���A���ʵ���Ũ�ȼ�С1/2����������ƽ��Ħ����������1/8����÷�Ӧ�Ļ�ѧ����ʽ��n��ֵ��
nC(g)+2D(g) ���ﵽƽ���A���ʵ���Ũ�ȼ�С1/2����������ƽ��Ħ����������1/8����÷�Ӧ�Ļ�ѧ����ʽ��n��ֵ��| A��1 | B��2 | C��3 | D��4 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com