
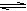 2SO3(g)。下列哪种量不再变化时,不能说明化学反应已经达到平衡状态的是
2SO3(g)。下列哪种量不再变化时,不能说明化学反应已经达到平衡状态的是| A.混合气体的总物质的量 | B.混合气体的总压强 |
| C.SO2的转化率 | D.混合气体的密度 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题

| A.负极的电极反应式为:CO + O2-―2e-=CO2 |
| B.工作时电子由电极a通过传感器流向电极b |
| C.工作时电极b作正极,O2-由电极a通过固体介质向电极b迁移 |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
 CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:| 物 质 | CO | H2 | CH3OH |
| 浓度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
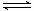 CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
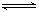 p C在某温度下达到平衡。
p C在某温度下达到平衡。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
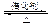 2SO3(g)。
2SO3(g)。 2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。
2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。容器 | SO2(mol) | O2(mol) | SO3(mol) | 热量(kJ) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 |
| 0 | Q2 |
丙 | 0 | 0 | 1 | Q3 |
 2 < Q3 < 197kJ
2 < Q3 < 197kJ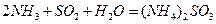
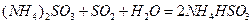
 提高燃煤烟气中
提高燃煤烟气中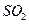 去除率的有 (填字母)。
去除率的有 (填字母)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min),则5min时,A的浓度为___ ___,B的平均反应速率为____ __,x的值是__ ____。
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min),则5min时,A的浓度为___ ___,B的平均反应速率为____ __,x的值是__ ____。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
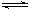 2C(g);△H<0
2C(g);△H<0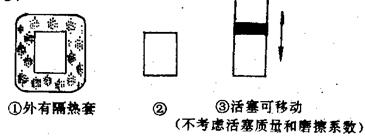
 、③中均投入3 mol A、1 mol B,则达到平衡时,两容器中C物质的物质的量浓度② ③(填<、>、=);
、③中均投入3 mol A、1 mol B,则达到平衡时,两容器中C物质的物质的量浓度② ③(填<、>、=);
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g)+qD (g);H <0有下列判断,其中正确的是
pC(g)+qD (g);H <0有下列判断,其中正确的是 体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<q+p
体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<q+p 化
化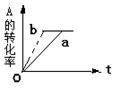
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3HF (正反应为吸热反应)
3HF (正反应为吸热反应) 2HF (正反应为吸热反应)
2HF (正反应为吸热反应)| A.若气体的平均摩尔质量为40 g/mol,则H3F3的体积分数可能为10% |
| B.若在定温定容下再充入H3F3,则H3F3与HF的浓度(mol/L)比值增大 |
| C.若气体的平均摩尔质量为42 g/mol,则H3F3的体积分数必小于10% |
| D.若在定温定容再充入HF,则H3F3与HF的浓度(mol/L)比值增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com