
分析 (1)计算1mol甲烷完全燃烧生成液态水放出的热量,注明物质的聚集状态与反应热书写热化学方程式;
(2)据固态硫加热形成气态硫要吸收能量,所以气态硫能量高结合△H=生成物的能量-反应物的能量解答.
(3)据压强增大时,平衡向气体体积减小的方向移动分析;
(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$.
解答 解:(1)1molCH4在氧气中燃烧生成CO2和液态水,放出热量为55.6kJ×$\frac{1mol×16×g/mol}{1g}$=889.6kJ热量,
则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ/mol;
(2)固态硫加热形成气态硫要吸收能量,所以气态硫能量高,又△H=生成物的能量-反应物的能量,1mol固态硫燃烧生成二氧化硫气体比1mol气态硫燃烧生成二氧化硫气体放出的热量少,则△H大,故答案为:>;
(3)体积不变,温度不变的条件下,再向该容器加入1molN2O4,由于生成物浓度增大,平衡逆向移动,但逆向移动时压强增大,所以,移动的结果不如原平衡,所以,N2O4的体积分数比原平衡大,故答案为:<;
(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-7}×5×1{0}^{-3}}{0.5a-5×1{0}^{-3}}$=$\frac{1{0}^{-9}}{a-0.01}$,
故答案为:中,$\frac{1{0}^{-9}}{a-0.01}$;
点评 本题考查弱电解质电离,热化学方程式的焓变的大小比较,根据电荷守恒确定溶液酸碱性,结合一水合氨电离平衡常数解答问题,注意二者混合后溶液体积增大一倍,物质浓度降为原来一半,为易错点,题目难度不大.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题
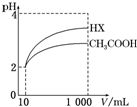 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸不能存放于玻璃瓶中 | |
| B. | 氯水存放于棕色试剂瓶中 | |
| C. | 少量金属钠保存在煤油中 | |
| D. | 氢氧化钠溶液存放于玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q3>Q2 | B. | Q1>Q2>Q3 | C. | Q2>Q1>Q3 | D. | Q3>Q2>Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应叙述 | 产物图示 |
| A | NaOH溶液与SO2 反应时溶液中的溶质 |  |
| B | NaAlO2溶液与盐酸反 应后铝元素的存在形式 |  |
| C | Fe和稀HNO3反应 后,铁元素的存在形式 | 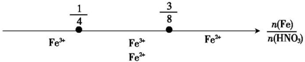 |
| D | Fe在Cl2中的燃烧产物 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 不小心将少量浓硫酸沾到皮肤,立即用水冲洗 | |
| B. | 如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液 | |
| C. | 为了避免浪费,应该把实验用剩的药品放回原试剂瓶中 | |
| D. | 连接并组装成套仪器时,一般按自下而上、从左到右的顺序进行安装 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
| 化学式 | H2CO3 | HClO | H2C4H4O6(酒石酸) |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com