
 (1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,离子反应方程式为
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,离子反应方程式为

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
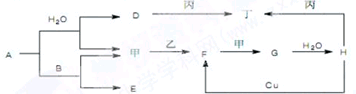
查看答案和解析>>
科目:高中化学 来源: 题型:

| 电离能/KJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1=Q2=57.3 |
| B、Q1>Q2>57.3 |
| C、Q1<Q2=57.3 |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C6H5CH2OH不属于醇类 |
| B、l mol苯最多能与3 mol H2加成,说明每个苯分子有3个碳碳双键 |
| C、苯和甲苯都能使KMnO4酸性溶液褪色 |
| D、1-氯丙烷和2-氯丙烷分别与NaOH乙醇溶液共热的反应产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对比等浓度的两种酸的pH |
| B、对比等浓度的两种酸,与相同大小镁条反应的初始速率 |
| C、对比等浓度、等体积的两种酸,与等量NaOH溶液反应后放出的热量 |
| D、对比等浓度、等体积的两种酸,与足量Zn反应,生成H2的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com