
【题目】下列去除杂质的方法错误的是()
A.NaCl中混有少量![]() 可采用给固体加热的方法
可采用给固体加热的方法
B.![]() 气体中混有少量CO气体可通入足量澄清石灰水
气体中混有少量CO气体可通入足量澄清石灰水
C.除去食盐溶液中所含的碳酸钠杂质可采用加入适量的硝酸钡溶液然后过滤的方法
D.去除淀粉溶液中的NaCl用渗析的方法
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知烃X在标況下的密度1.25g/L,液态烃A摩尔质量为106g/mol,C是油脂皂化反应后的产物之一,具吸水保湿功能,D是有芳香气味的酯。它们之间的转化如下图所示(含有相同官能团的有机物通常具有相似的化学性质)
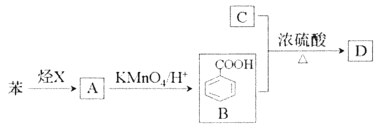
请回答
(1)烃X所含官能团的名称是_______。
(2)A→B的反应类型是_________。
(3)B与C按3:1反应生成D的化学方程式为_______。
(4)下列说法正确的是_______。
A.邻二溴苯只有一种结构,证明苯环结构中不存在单双键交替结构
B.上述六种有机物都能与H2发生加成反应
C.可用新制Cu(OH)2鉴别B、C、D
D.相同质量的苯与苯甲酸充分燃烧消耗等量的O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种短周期元素在周期表中的相对位置如右表,其中D的原子序数是A的原子序数的3倍。A与D组成的物质是一种超硬耐磨涂层材料,图3为其晶体结构中最小的重复结构单元,其中的每个原子最外层均满足8电子稳定结构。下列有关说法正确的是

A. A与D组成的物质的化学式为BP,属于离子晶体
B. A与D组成的物质熔点高,且熔融状态下能导电
C. A与D组成的物质中原子间以共价键连接,属于原子晶体
D. A与D组成的化合物晶体中,每个A原子周围连接1个D原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由![]() 和
和![]() 组成的混合气体与同温同压下空气的密度相等
组成的混合气体与同温同压下空气的密度相等![]() 空气的平均相对分子质量为29,
空气的平均相对分子质量为29,![]() 则下列关系正确的是()
则下列关系正确的是()
A.混合气体中,![]() 占有的体积大于
占有的体积大于![]() 占有的体积
占有的体积
B.混合气体中,![]() 与
与![]() 分子个数比为1:2
分子个数比为1:2
C.混合气体中,![]() 与
与![]() 质量比为15:14
质量比为15:14
D.混合气体中,![]() 与
与![]() 密度比为14:15
密度比为14:15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图。

(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)____(填“增大”、“减小”或“不变”,下同),转化率α(C3H8)_____。
②温度升高,副反应更容易发生的主要原因是__________________________________。
(2)下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分
别为104 Pa和105 Pa)。

①104 Pa时,图中表示丙烯的曲线是____(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②104 Pa、500 ℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=_____(已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。
该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为△H =-283.0 kJ·mol-1、△H =-285.8 kJ·mol-1。
①图中催化剂为______。
②298 K 时,该工艺总反应的热化学方程式为_____________________________________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4-环己二酮单乙二醇缩酮)为原料合成(如下图)。

试填空:
(1)X的分子式为 _____ ;该分子中最多共面的碳原子数为 ____ 。
(2)Y中是否含有手性碳原子______(填“是”或“否”)。
(3)Z能发生 ____ 反应。(填序号)
A.取代反应 B.消去反应 C.加成反应
(4)1molZ与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠 ______mol;1molZ与足量的浓溴水充分反应,需要消耗Br2 _____ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 用20gNaOH配成250mL溶液,它的物质的量浓度为 ______
用20gNaOH配成250mL溶液,它的物质的量浓度为 ______ ![]() 取出5mL该溶液,它的物质的量浓度为 ______ ,再加水稀释至100mL,则稀释后溶液的物质的量浓度为 ______ ,其中含NaOH的质量为 ______
取出5mL该溶液,它的物质的量浓度为 ______ ,再加水稀释至100mL,则稀释后溶液的物质的量浓度为 ______ ,其中含NaOH的质量为 ______ ![]() 该100mL溶液可以跟
该100mL溶液可以跟![]() 的硫酸溶液 ______ mL完全中和生成
的硫酸溶液 ______ mL完全中和生成![]() .
.
![]() 气态化合物A的化学式可以表示为
气态化合物A的化学式可以表示为![]() ,已知同温同压下10mLA受热完全分解生成
,已知同温同压下10mLA受热完全分解生成![]() 和10mL
和10mL![]() ,则A的化学式为 ______ .
,则A的化学式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。

已知:I.NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
II.NaNH2熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
(1)装置B中盛放的药品为_____________;装置C的主要作用是______________________。
(2)步骤①中先加热通氨气的目的是_____________________________________;步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为_______________________________。步骤③中最适宜的加热方式为 ___________(填“水浴加热”,“油浴加热”)。
(3)N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),则可选择的气体发生装置是(填序号)___________。

(4)生成NaN3的化学方程式为 _____________________________________。
(5)图中仪器a用的是铁质而不用玻璃,其主要原因是__________________。
(6)步骤④中用乙醚洗涤的主要目的是_______________________________。
(7)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL溶液。②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.1010 mol·L-1(NH4)2Ce(NO3)6溶液。③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+;试样中NaN3的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:①CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
则下列说法正确的是

A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知上图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)ΔH=-41.2 kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要吸收能量
D. 根据②推知反应H2(g)+1/2O2(g)=H2O(l)ΔH>-241.8 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com