
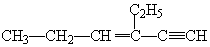
 ,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )| A. | 4、3、6 | B. | 4、3、8 | C. | 2、5、4 | D. | 4、4、6 |
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2、HClO、SO2等物质都具有漂白作用 | |
| B. | 纯碱和小苏打都是碱 | |
| C. | 所有的置换反应都是氧化还原反应,而所有的复分解反应都是非氧化还原反应 | |
| D. | 非金属氧化物不一定是酸性氧化物,有些金属氧化物也能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度 | |
| B. | 若2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol,则碳的燃烧热为110.5KJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知I:反应H2(g)+Cl2(g)=2HCl(g);△H=-akJ/mol II:  且a、b、c均大于零,则断开1molH-Cl键所需的能量为2(a+b+c)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
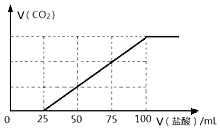 向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.
向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com