
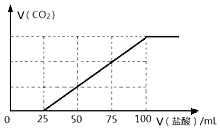
 向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.
向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.分析 (1)入100mL盐酸时二氧化碳的体积达最大,此时溶液为NaCl溶液,根据氯离子、钠离子守恒,n(NaOH)=n(NaCl)=n(HCl),据此计算出氢氧化钠的物质的量,再根据物质的量浓度的定义计算;
(2)当向100mLNaOH溶液中通入一定量的CO2气体25mL时,可能发生的反应有:2NaOH+CO2═Na2CO3+H2O或NaOH+CO2═NaHCO3两种可能的情况,通过图象关系,当向溶液中加盐酸的体积25mL时,无气体出现,说明此段内发生了如下反应:HCl+Na2CO3═NaHCO3+NaCl,在加盐酸时产生气体,发生NaHCO3+HCl═CO2↑+NaCl,结合反应及图中数据计算.
解答 (1)加入100mL盐酸时二氧化碳的体积达最大,此时溶液为NaCl溶液,根据氯离子、钠离子守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.1L×2mol/L=0.2mol,所以c(NaOH)=$\frac{0.2}{0.1}$=2mol/L=0.2mol/L,故答案为2mol/L;
(2)向100mLNaOH溶液中通入一定量的CO2气体25mL时,可能发生的反应有:2NaOH+CO2═Na2CO3+H2O或NaOH+CO2═NaHCO3两种可能的情况,通过图象关系,当向溶液中加盐酸的体积25mL时,无气体出现,说明此段内发生了如下反应:HCl+Na2CO3═NaHCO3+NaCl,在加盐酸时产生气体,根据当加盐酸反应完毕时,消耗盐酸100mL,溶液中有则有 Na2CO3 xmol,生成 NaHCO3 mmol.
Na2CO3 +HCl═NaHCO3+NaCl
1mol 1mol 1mol
x 0.025L×2mol/L mmol
解得:x=0.05mol,m=0.05mol
设75mL盐酸反应的NaHCO3的物质的量ymol,则有
NaHCO3+HCl═CO2↑+NaCl
1mol 1mol
ymol 0.075L×2mol/L
解得:y=0.15mol,
则A中含Na2CO3 0.05mol,NaHCO3为0.15mol-0.05mol=0.1mol,
低温低压NaHCO3加热 不分解,m=m(Na2CO3)+m(NaHCO3)=0.05×106+0.1×84=13.7g
故答案为:Na2CO3和NaHCO3;13.7 g
点评 本题考查了元素化合物的性质,结合图象的将反应关系与反应有机的结合起来,对图象的分析,是解决题目的关键,易出错在图象分析不到位,同时化学变化关系分析不出来.


科目:高中化学 来源: 题型:实验题

| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 加入几小块CaCO3固体 | 有气泡产生 | |
| ② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
| ③ | 滴加少量溴水,振荡 | Ⅱ | |
| ④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

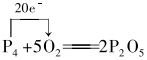 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W三种元素组成的化合物的水溶性一定显碱性 | |
| B. | 原子半径:X<Y<Z<R<W | |
| C. | R元素的最高价氧化物的水化物酸性最强 | |
| D. | Y和其他四种元素均可形成至少两种化合物(两种元素组成) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
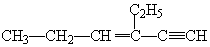 ,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )| A. | 4、3、6 | B. | 4、3、8 | C. | 2、5、4 | D. | 4、4、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的酸和碱的物质的量相等 | |
| B. | 参加反应的酸中的H+总量和碱中的OH-总量相等 | |
| C. | 反应后混合液的pH=7 | |
| D. | 不能用适当的酸碱指示剂来判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
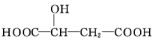 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 苹果酸不能发生聚合反应 | |
| B. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| C. | 苹果酸分子的核磁共振氢谱有四组峰,峰面积之比为1:1:2:2 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 比较Mg(OH)2与Al(OH)3的碱性强弱,判断镁与铝的金属性强弱 | |
| C. | 往硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | 根据HF和HCl的水溶液的酸性强弱判断氟与氯的非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
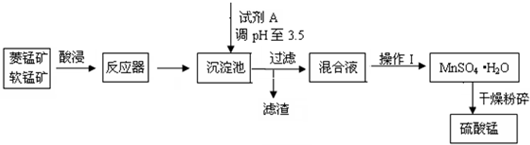
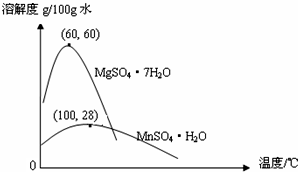
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com