
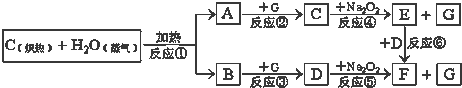
| 1 |
| 2 |
| 28n1+2n2 |
| n1+n2 |
| 1 |
| 2 |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| Ca(OH)2悬浊液 |
| 加热 |
| HBr |
| 一定条件 |
| NaOH水溶液 |
| 酸化 |
| 浓H2SO4 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MnO4- Na+ SO42-K+ |
| B、Fe2+ Na+ Cl- NO3- |
| C、K+ Na+ Cl- CO32- |
| D、K+ NH4+ SO42- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.54g |
| B、3.34g |
| C、2.57g |
| D、2.34g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+) |
| B、元素W的最高价氧化物对应水化物的酸性比Q的强 |
| C、元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
| D、X、Y形成的化合物是大气污染物之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、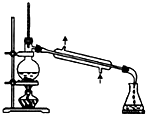 常用于分离互不相溶液体混合物 |
B、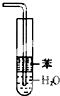 可用于吸收HCl气体,并能防倒吸 |
C、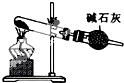 可用于实验室制NH3 |
D、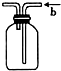 b口进气可收集CO2、NO等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A、足量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-=HClO+HSO3- |
| B、向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度 |
| C、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3 |
| D、NaHSO3溶液中离子浓度大小顺序为:c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com