

| 250 |
| 25 |
| 0.5mol×56g/mol |
| 7.84g |


科目:高中化学 来源: 题型:

| 常温下状态 | 溶解性 | 稳定性 |
| 白色固体 | 易溶于水和乙醇,难溶于CCl4 | 在干燥空气中稳定,在湿空气中放出氨转化为NH4HC03,59时分解为NH3和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:16 | B、16:1 |
| C、17:7 | D、7:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
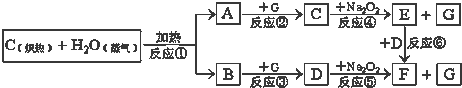
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 | 1.8×l0-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 用图能证明酸性:硫酸>碳酸>次氯酸 |
B、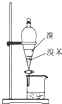 用图所示装置分离出溴苯 |
C、 用图设计成铜锌原电池装置 |
D、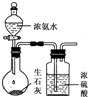 用图制取干燥的氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com