
【题目】LiOH是制备锂离子电池的材料,可由电解法制备。工业上利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法正确的是
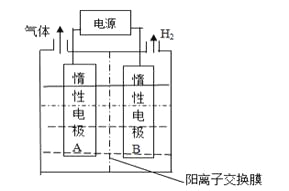
A.B极区电解液为LiOH溶液
B.电极每产生22.4L气体,电路中转移2mole-
C.电解过程中Li+迁移入B电极区、OH-迁移入A电极区
D.电解池中总反应方程式为:2HCl![]() 2H2↑+Cl2↑
2H2↑+Cl2↑
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”;锡酸钠可用于制造陶瓷电容器的基体,陶瓷电容器在宇航、导弹、航海等方面有着重要的用途。以锡碲渣(主要含Na2SnO3和Na2TeO3)为原料,制备锡酸钠和碲的流程图如图:
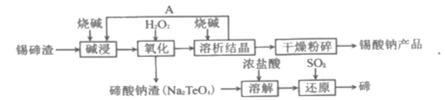
已知:锡酸钠(Na2SnO3)和亚碲酸钠(Na2TeO3)均易溶于碱。
(1)在生产过程中,要将锡碲渣粉碎,其目的是___。
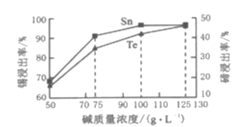
(2)“碱浸”过程中,锡碲浸出率与溶液中碱的质量浓度关系如图所示,最理想的碱的质量浓度为100g/L,其理由是___。
(3)“氧化”时,反应的离子方程式为___;“氧化”的温度控制在60℃~70℃之间,其原因是___。
(4)“还原”反应的化学方程式为___。
(5)以石墨为电极电解Na2TeO3溶液可获得Te,电解过程中阴极上的电极反应为___。
(6)常温下,向lmolL-1Na2TeO3溶液中滴加盐酸,当溶液中c(TeO32-):c(H2TeO3)=0.2时,pH=___。(已知:H2TeO3的电离平衡常数Ka1=1.0×10-3,Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种常用氧化剂,主要用于化工、防腐及制药工业等。可将软锰矿(主要成分为MnO2)和KClO3在碱性介质中制得K2MnO4,然后通入CO2制备高锰酸钾。已知:
温度 | 溶解度/g | ||||
K2CO3 | KHCO3 | KMnO4 | K2SO4 | CH3COOK | |
20℃ | 111 | 33.7 | 6.38 | 11.1 | 217 |
(1)制备锰酸钾的主要反应为:3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O
①该反应中的氧化剂是_____________,还原剂是_____________。
②每生成 1mol K2MnO4转移_______ mol 电子。
(2)通入少量CO2气体时,锰酸钾发生歧化反应,生成KMnO4,MnO2,K2CO3。
①则生成的 KMnO4与MnO2的物质的量之比为__________。
②若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低,其原因是______________________________,可以把通CO2改为加其他的酸。从理论上分析,选用下列酸中_______,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:________,其中电子占据的轨道数为________个。
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为________,羟基间的相互作用力为________。
(3)不同大小的苯芳烃能识别某些离子,如:![]() 、SCN-等。一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。
、SCN-等。一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。
(4)NH3分子在独立存在时H-N-H键角为106.7°。如图 [Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:______。
(5)橙红色的八羰基二钴[Co2(CO)8]的熔点为52℃,可溶于乙醇、乙醚、苯等有机溶剂。该晶体属于________晶体,八羰基二钴在液氨中被金属钠还原成四羰基钴酸钠[NaCo(CO)4],四羧基钴酸钠中含有的化学键为_________________。
(6)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):

则一个C60分子中含有σ键的个数为________,C60晶体密度的计算式为________ g·cm-3。(NA为阿伏伽德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于如图所示原电池的说法正确的是
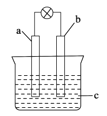
A.当a为Cu,b为含有碳杂质的 Al,c 为稀硫酸时,b 极上观察不到气泡产生
B.当a为石墨,b为 Fe,c为浓硫酸时,不能产生连续的稳定电流
C.当a为Mg,b为 Al,c为NaOH 溶液时,根据现象可推知 Al 的活动性强Mg的
D.当a为石墨,b为 Cu,c为FeCl3 溶液时,a、b之间没有电流通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含 Na2CO3·xH2O和 NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的 CO2 和 H2O的质量,来确定 Na2CO3··xH2O中 x的数值。
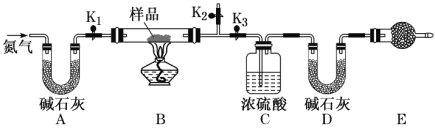
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,检查装置的气密性。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶 C 的质量和盛装碱石灰的 U形管 的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入氮气数分钟,其目的是_________________________。
④关闭活塞K1、K2,打开 K3,点燃酒精灯,加热至不再产生气体。加热时 NaHCO3 发生反应的化学方程式为___________________________________。
⑤打开活塞 K1,缓缓鼓入氮气数分钟,然后拆下装置,再次称量洗气瓶C的质量和 U形管 D的质量。
(2)关于该实验方案,请回答下列问题。
①装置 E的名称是_________,E中盛放的试剂也是碱石灰,其作用是_______________________________。
②若样品质量为 29.3 g,反应后 C、D 装置增加的质量分别为 9 g、4.4 g,则 Na2CO3·xH2O中x为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萝卜硫素(结构如图)是具有抗癌和美容效果的天然产物之一,在一些十字花科植物中含量较丰富。该物质由五种短周期元素构成,其中W、X、Y、Z的原子序数依次增大,Y、Z原子核外最外层电子数相等。下列叙述一定正确的是( )
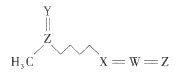
A.原子半径的大小顺序为Z>W>X>Y
B.X的简单氢化物与W的氢化物反应生成离子化合物
C.萝卜硫素中的各元素原子最外层均满足8电子稳定结构
D.Y、Z形成的二元化合物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断正确的是
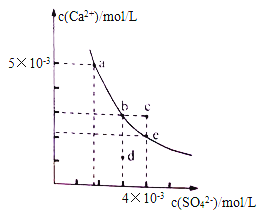
A. 曲线上任意一点的Ksp都相同
B. 在CaSO4饱和溶液中加入Na2SO4固体,可使溶液由b点变化到c点
C. 蒸发水后,可使溶液由d点变化到b点
D. 常温下,CaSO4的Ksp的数量级为10-5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com