
已知反应:3I-(aq)+S2O82-(aq)  I3-(aq)+2SO42-(aq)+Q
I3-(aq)+2SO42-(aq)+Q
(1)写出反应的平衡常数表达式:K= 。
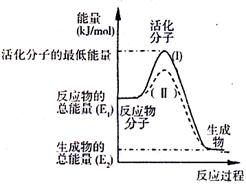
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q 0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是 曲线。

(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。下表是在20℃进行实验时所记录的数据
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.160 |
|
c(S2O82-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.080 |
0.040 |
|
t/s |
88 |
44 |
22 |
11 |
t1 |
从表中数据分析,该实验的目的是 ;
表中显色时间t1= s;最终得出的结论是 。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省攀枝花市高三第二次统考化学试卷(解析版) 题型:选择题
TiO2在工业生产和日常生活中有重要用途。
(1)工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤②发生的主要反应为:2H2SO4+FeTiO3 == TOSO4(硫酸氧钛)+FeSO4+2H2O
净化钛矿石时,需用浓氢氧化钠溶液来处理。写出该过程中发生反应的化学方程式:________________。
步骤③中加热的目的是(请写出必要的化学方程式和文字): 。
(2)用TiO2制备金属钛的一种方法是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:TiO2(s)+2Cl2(g) TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
已知:C(s)+O2(g)=CO2(g) △H= 394
kJ/mol。
394
kJ/mol。
则TiO2(s)+C(s)+2Cl2(g)=TiCl4(1)+CO2(g) △H=________
从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因是_______________。
(3)下图是一种染料敏化太阳能电池的示意图。电池的一个由有机光敏染料(S)涂覆TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:

TiO2/S TiO2/S*
(激发态)
TiO2/S*
(激发态)
TiO2/S*  TiO2/S+
+ e-
TiO2/S+
+ e-
I3-+2e- 3I-
3I-
2TiO2/S*+I3-  2TiO2/S + I3-
2TiO2/S + I3-
下列关于该电池叙述正确的是
A.电池工作时,I-离子在镀铂导电玻璃电极上放电
B.电池工作时,是将太阳能转化为电能
C.电池的电解质溶液中I-和I3- 浓度不会减少
D.电池中镀铂导电玻璃为正极
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)化学实验必须注意安全,下列做法存在安全隐患的是___________(选填字母)。
A.氢气还原氧化铜实验中,先加热氧化铜后通氢气
B.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
C.实验室做钠的实验时,余下的钠屑投入到废液缸中
D.配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
E.皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F.制乙烯时,用量程为300 ℃的温度计代替量程为200 ℃的温度计,测反应液的温度
(2)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I-作用定量析出I2,I2溶于过量的KI溶液中:
I2+I-====![]() ,又知氧化性:Fe3+>Cu2+>I2>
,又知氧化性:Fe3+>Cu2+>I2>![]() 。
。
析出的I2可用c mol·L-1 Na2S2O3标准溶液滴定:2![]() +
+![]() ====
====![]() +3I-。
+3I-。
准确称取a g胆矾试样,置于250 mL碘量瓶(带磨口塞的锥形瓶)中,加50 mL蒸馏水、5 mL 3 mol·L-1 H2SO4溶液,加少量NaF,再加入足量的10% KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5 min,充分反应后,加入1—2 mL 05%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去V mL标准液。
①实验中,在加KI前需加入少量NaF,推测其作用可能是:______________________。
②实验中加入5 mL 3 mol·L-1 H2SO4溶液,你认为硫酸的作用是:_______________________。
③本实验中用碘量瓶而不用普通锥形瓶是因为:_____________________________________。
④硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:____________________________________________________________________。
⑤根据本次实验结果,该胆矾试样中铜元素的质量分数为w(Cu)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
I、已知反应:
3I-(aq)+S2O82-(aq) ![]() I3-(aq)+2SO42-(aq);
I3-(aq)+2SO42-(aq);
(1)写出反应的平衡常数表达式
 K= 。
K= 。
(2)右图表示反应过程中有关物质的能量,则反应
的 △H 0(填>、<、=)。
(I)、(II)两线中,使用催化剂的是 线。
(3)反应中发生反应的I-与被氧化的I-的物质的量比为 。
(4)反应的速率可以用I3-与加入的淀粉溶液反应是蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-/mol·L-1) | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
则:该实验的目的是
显色时间t1= s
分析表中数据,得出的结论是
II、二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。
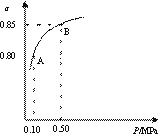 根据图示回答下列问题。
根据图示回答下列问题。
①平衡状态由A变到B时,平衡常数K(A) K(B)
(填“>”、“<”、“=”)。
②已知上述反应的是放热反应,当该反应处于平衡状态时,
在体积不变的条件下,下列选项中有利于提高SO2平衡转
化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
E.加入催化剂 F.移出氧气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com