
| A、电负性的大小顺序为Cl>S>P |
| B、由于NO3-和SO3互为等电子体,所以可以推断NO3-的空间构型为平面三角形 |
| C、根据晶格能的大小可以判断MgCl2的熔点比CaCl2高 |
| D、液态HF的沸点比液态HCl的沸点高是因为氢氟键的键能比氢氯键的键能大. |
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| -H2O |
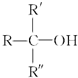 不能被氧化剂氧化(R,R′,R″均表示烃基),根据上述反应机理回答下列问题:
不能被氧化剂氧化(R,R′,R″均表示烃基),根据上述反应机理回答下列问题: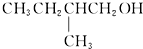 在有Cu和加热条件下与O2反应的化学方程式
在有Cu和加热条件下与O2反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
 :已知
:已知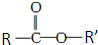 和NaOH反应能生成RCOONa和R′OH,下列叙述正确的是( )
和NaOH反应能生成RCOONa和R′OH,下列叙述正确的是( )| A、M的相对分子质量是180 |
| B、1mol M最多能与2mol Br2发生反应 |
| C、M与足量的Na溶液发生反应时,所得有机产物的化学式为C9H4O4Na2 |
| D、1mol M与足量NaHCO3反应能生成2mol CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4种 | B、3种 |
| C、16种 | D、32种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应容器中的气体压强不随时间而变化 |
| B、生成O2的速率与生成NO2的速率相等 |
| C、NO、O2、NO2各浓度之比为2:1:2 |
| D、混合气体的密度一定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3O4与稀硝酸反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B、SO2通入Ba(NO3)2溶液中:Ba2++SO2+H2O=BaSO3↓+2H+ |
| C、硫酸铵溶液与Ba(OH)2溶液反应:Ba2++SO42-=BaSO4↓ |
| D、FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol/L HCl溶液50mL |
| B、0.6mol/L Al2(SO4)3溶液40mL |
| C、0.7mol/L NaCl溶液70mL |
| D、0.8mol/L Na2CO3溶液60mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com