
【题目】苯甲酸钠(NaA)可作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2。已知25 ℃时,HA、H2CO3的电离平衡常数分别为K=6.25×10-5、 K1=4.3×10-7,则下列说法正确的是(不考虑饮料中其他成分)
A. 提高CO2充气压力,饮料中c(A-)不变
B. 当pH为5.0时,饮料中![]() =0.16
=0.16
C. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
D. 结合H+的能力:A->HCO3-
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】FeS、FeS2在酸性条件下都能与重铬酸钾(K2Cr2O7)溶液反应,还原产物为Cr3+,氧化产物都是Fe3+、SO42-。等物质的量FeS、FeS2完全反应时,消耗氧化剂的物质的量之比为
A.5:3B.9:17C.3:5D.3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中:①MgCl2 ②金刚石 ③Na2O2 ④H2O ⑤NaCl ⑥Ne ⑦H2SO4 ⑧NH4Cl ⑨CO2 ⑩O2
只含离子键的是_______________,只含共价键的是_______________,
既含离子键又含共价键的是_______________,不存在化学键的是______________,
属于离子化合物的是______________,属于共价化合物的是____________________。
(2)已知拆开1 mol H—H键、1 mol N≡N键、1 mol N—H键分别需要吸收的能量为436 kJ、946 kJ、391 kJ,则1 mol NH3分解为N2和H2时,该反应需要___________(填“放出”或“吸收”)______kJ的热量。
(3)将1 mol N2和3 mol H2充入密闭容器中,在一定条件下发生反应N2+3H2![]() 2NH3,下列说法正确的是________。
2NH3,下列说法正确的是________。
a.最终生成2 mol NH3b.可逆反应达到平衡时,反应停止
c.当v正(H2)=v逆(N2)时,反应达到平衡
d.达到平衡时,反应达到了最大限度
e.平衡时各组分的物质的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见的某反应化学方程式为X +Y→M+N +H2O(未配平,反应条件已略去),下列叙述错误的是
A. 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
C. 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3- = Fe3+ +NO↑+2H2O
D. 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型水系钠离子电池工作原理如图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4 还原为 Na2S。下列说法不正确的是

A. 充电时,太阳能转化为电能,电能又转化为化学能
B. M 是阴离子交换膜
C. 放电时,a 极为负极
D. 充电时,阳极的电极反应式为 3I--2e-=I3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO![]() 、CO
、CO![]() 、SO
、SO![]() 、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是

A. 原溶液中一定只存在![]() 、
、![]() 、
、![]() 、Cl-四种离子
、Cl-四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++3OH===Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 和浓盐酸在一定温度下反应会生成
和浓盐酸在一定温度下反应会生成![]() ,反应方程为
,反应方程为![]() (浓)==
(浓)==![]() ,浓盐酸在该反应中表现出的性质是__________。
,浓盐酸在该反应中表现出的性质是__________。
(2)实验室常用![]() 、草酸(
、草酸(![]() )和稀硫酸制备
)和稀硫酸制备![]() 。该反应中氧化产物与还原产物物质的量之比为__________。
。该反应中氧化产物与还原产物物质的量之比为__________。
(3)将![]() 通入到硫化氢溶液中,然后加入少量的稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式______________________________。
通入到硫化氢溶液中,然后加入少量的稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式______________________________。
(4)![]() 和
和![]() 在消毒时自身均被还原为
在消毒时自身均被还原为![]() ,则常温常压下,等体积的
,则常温常压下,等体积的![]() 的消毒能力是
的消毒能力是![]() 的__________倍。
的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内。下列关于萜类化合物a、b的说法错误的是

A. a与 ![]() 互为同分异构体
互为同分异构体
B. b中能发生消去反应
C. b生成1 mol 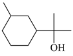 至少需要 3 mol H2
至少需要 3 mol H2
D. a中六元环上的一氯代物共有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
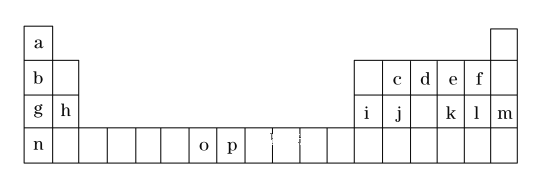
试回答下列问题:
①表中碱性最强的为_______(写出化学式);氢化物稳定性最强的为 ______ ;(写出化学式)
②基态o原子的价电子排布图为______;P3+离子与KSCN反应新生成的化学键为 _____ 键。
③将周期表中g、h、i、j四种元素的第一电离能由大到小排序为_________ (用元素符号表示)。
(二)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si之间插入O原子而形成。
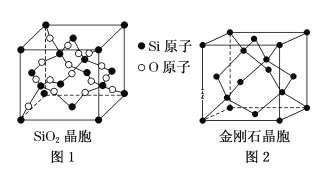
①推测SiO2晶胞中Si采用______杂化,O—Si—O的键角为___________。
②一个SiO2晶胞中,含有_______个Si原子。
③金刚石和晶体硅都是原子晶体,具有相似的结构,则熔点:金刚石_______Si晶体(填“大于”,“等于”或“小于”)
④假设金刚石晶胞的边长为a pm,NA为阿伏伽德罗常数,试计算该晶胞的密度______ g·cm-3(写出表达式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com