
【题目】(1)下列物质中:①MgCl2 ②金刚石 ③Na2O2 ④H2O ⑤NaCl ⑥Ne ⑦H2SO4 ⑧NH4Cl ⑨CO2 ⑩O2
只含离子键的是_______________,只含共价键的是_______________,
既含离子键又含共价键的是_______________,不存在化学键的是______________,
属于离子化合物的是______________,属于共价化合物的是____________________。
(2)已知拆开1 mol H—H键、1 mol N≡N键、1 mol N—H键分别需要吸收的能量为436 kJ、946 kJ、391 kJ,则1 mol NH3分解为N2和H2时,该反应需要___________(填“放出”或“吸收”)______kJ的热量。
(3)将1 mol N2和3 mol H2充入密闭容器中,在一定条件下发生反应N2+3H2![]() 2NH3,下列说法正确的是________。
2NH3,下列说法正确的是________。
a.最终生成2 mol NH3b.可逆反应达到平衡时,反应停止
c.当v正(H2)=v逆(N2)时,反应达到平衡
d.达到平衡时,反应达到了最大限度
e.平衡时各组分的物质的量一定相等
【答案】①⑤ ②④⑦⑨⑩ ③⑧ ⑥ ①③⑤⑧ ④⑦⑨ 吸收 46 d
【解析】
(1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,由此分析解答;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算:焓变=反应物总键能生成物的总键能,以此计算反应热并判断吸热还是放热;
(3)根据化学平衡的特征进行分析。
(1)①MgCl2中镁离子和氯离子之间只存在离子键,为离子化合物;
②金刚石中C原子之间只存在共价键,为单质;
③Na2O2中钠离子与过氧根离子之间存在离子键,氧氧之间存在非极性键,是离子化合物;
④H2O 中只存在共价键,为共价化合物;
⑤NaCl中钠离子和氯离子之间存在离子键,为离子化合物;
⑥Ne为单原子分子,不存在化学键;
⑦H2SO4中原子之间只存在共价键,为共价化合物;
⑧NH4Cl中铵根离子和氯离子之间存在离子键,N原子和H原子之间存在共价键,为离子化合物;
⑨CO2中C原子和O原子之间存在共价键,为共价化合物;
⑩O2中O原子之间只存在共价键,为单质;
所以只含离子键的是①⑤,只含共价键的是②④⑦⑨⑩; 既含离子键又含共价键的是③⑧,不存在化学键的是⑥,属于离子化合物的是①③⑤⑧,属于共价化合物的是④⑦⑨;
(2)在反应2NH3N2+3H2中,反应掉2mol NH3,共断裂6mol NH键,吸收的能量为:6×391kJ=2346kJ,生成3mol HH键、1mol N≡N键共放出的能量为:3×436kJ+946kJ=2254kJ,吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2346kJ2254kJ=92kJ,所以当1molNH3分解吸收热量为46kJ;
(3)a.可逆反应不可能完全转化,所以最终生成NH3的物质的量小于2 mol,故a错误;
b.化学平衡状态是动态平衡,达到平衡时,反应没有停止,故b错误;
c.用不同物质表示的化学反应速率之比等于化学计量数之比,则v正(H2)=3v正(N2),当v正(H2)=v逆(N2)时,3v正(N2)=v逆(N2),反应没有达到平衡,故c错误;
d.反应达到了最大限度时即为达到平衡状态,故d正确;
e.平衡时同种物质的正逆反应速率相等,各组分的物质的量保持不变,但不一定相等,故e错误;答案选d。


科目:高中化学 来源: 题型:
【题目】铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素质量的关系曲线,如图2所示。则下列分析正确的是( )
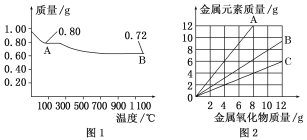
A. 图1中,A到B的过程中有0.005 mol电子发生了转移
B. 图1整个过程中共生成0.18 g水
C. 图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A
D. 图1中A和B化学式分别为Cu2O和CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁条,再滴入5 mL的稀盐酸。
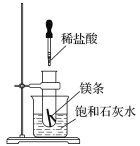
回答下列问题:
(1)实验中观察到的现象是____________________________________________。
(2)产生上述现象的原因是_________________________________________________。
(3)写出有关反应的离子方程式_________________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾常用作消毒杀菌、水质净化剂等。某小组用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。
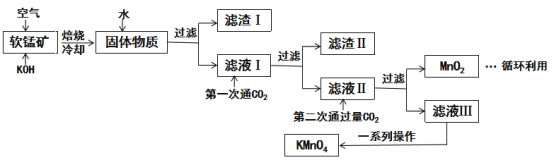
(1)焙烧过程中发生的主要反应为MnO2+KOH+O2![]() K2MnO4+H2O,该反应配平后MnO2与O2的化学计量数比为________。采用对空气加压的方法可以提高MnO2的利用率,原因是_________________。
K2MnO4+H2O,该反应配平后MnO2与O2的化学计量数比为________。采用对空气加压的方法可以提高MnO2的利用率,原因是_________________。
(2)滤渣Ⅱ是________,第一次通CO2不能用稀硫酸代替的原因是_____________。
(3)第二次通入过量的CO2生成MnO2的离子方程式为___________________。
(4)由图可知,从滤液Ⅲ得到KMnO4需经过__________________、洗涤等操作。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白桦脂酸对白血病等恶性肿瘤细胞有抑制作用,其结构简式如图所示,在白桦脂酸中加入合适的试剂检验其官能团(必要时可加热),下列试剂、现象、结论都正确的一项是

选项 | 试剂 | 现象 | 结论 |
A | 氯化铁溶液 | 溶液变色 | 含有羟基 |
B | 银氨溶液 | 有银镜产生 | 含有醛基 |
C | 碳酸氢钠溶液 | 有气泡产生 | 含有羧基 |
D | 酸性KMnO4溶液 | 溶液褪色 | 含有碳碳双键 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应:X2(g)+3Y2(g) 2Z2(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是

A.t2~t3时,各物质的浓度不再发生变化
B.t2时,反应未达到限度
C.t2~t3时,反应已停止进行
D.t1时,反应只向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠(NaA)可作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2。已知25 ℃时,HA、H2CO3的电离平衡常数分别为K=6.25×10-5、 K1=4.3×10-7,则下列说法正确的是(不考虑饮料中其他成分)
A. 提高CO2充气压力,饮料中c(A-)不变
B. 当pH为5.0时,饮料中![]() =0.16
=0.16
C. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
D. 结合H+的能力:A->HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种气体进行下列反应:3X+Y ![]() 2Z,在三种不同情况下测得的速率值为:
2Z,在三种不同情况下测得的速率值为:
① v(X)=1 mol·L-1·s-1; ② v(Y)=0.5 mol·L-1·s-1; ③ v(Z)=0.5 mol·L-1·s-1。
这三种情况下反应的速率大小情况为
A. ③>②>① B. ②>①>③ C. ①>②>③ D. ③>①>②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com