
【题目】高锰酸钾常用作消毒杀菌、水质净化剂等。某小组用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。
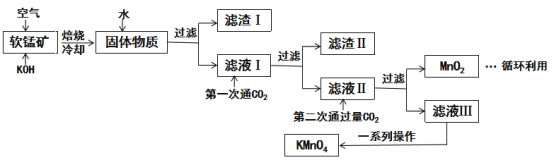
(1)焙烧过程中发生的主要反应为MnO2+KOH+O2![]() K2MnO4+H2O,该反应配平后MnO2与O2的化学计量数比为________。采用对空气加压的方法可以提高MnO2的利用率,原因是_________________。
K2MnO4+H2O,该反应配平后MnO2与O2的化学计量数比为________。采用对空气加压的方法可以提高MnO2的利用率,原因是_________________。
(2)滤渣Ⅱ是________,第一次通CO2不能用稀硫酸代替的原因是_____________。
(3)第二次通入过量的CO2生成MnO2的离子方程式为___________________。
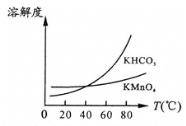
(4)由图可知,从滤液Ⅲ得到KMnO4需经过__________________、洗涤等操作。
【答案】2:1 加压增大氧气的浓度,反应速率加快,使MnO2反应更充分 Al(OH)3、H2SiO3 不易控制硫酸的用量,过量的硫酸会使 Al(OH)3溶解(或酸性过强会使K2MnO4过早歧化) 3MnO42- + 4CO2 + 2H2O = MnO2↓+ 2MnO4- + 4HCO3- 蒸发结晶,趁热过滤
【解析】
软锰矿主要成分MnO2与KOH混合在空气中焙烧,冷却得到固体物质,溶于水过滤得到滤渣I和滤液I,滤液I中应含有K2SiO3,KAl(OH)4、K2MnO4等溶质,滤渣I为Fe2O3;向滤液I中第一次通入CO2与K2SiO3、KAl(OH)4发生反应,过滤得到滤渣Ⅱ和滤液Ⅱ,滤渣Ⅱ为Al(OH)3、H2SiO3;滤液Ⅱ含有KHCO3,K2MnO4等溶质;向滤液Ⅱ中第二次通入过量CO2,再次过滤得到滤液Ⅲ和MnO2,滤液Ⅲ中含有KMnO4和KHCO3,再经过一系列操作得到较纯的KMnO4,MnO2可以循环利用。
(1)焙烧时MnO2与KOH在空气中O2的作用下反应得到K2MnO4和H2O,反应为氧化还原反应,Mn化合价升高2,O化合价降低2,根据电子转移数守恒,所以在MnO2前面配上2,O2前面配上1,根据Mn元素守恒,在K2MnO4前面配上系数2,再根据K元素守恒,在KOH前面配上4,最后根据H元素守恒,在H2O前面配上2,2MnO2+4KOH+O2![]() 2K2MnO4+2H2O。该反应配平后MnO2与O2的化学计量数比为2:1,采用对空气加压的方法可以提高MnO2的利用率,原因是加压增大氧气的浓度,反应速率加快,使MnO2反应更充分。
2K2MnO4+2H2O。该反应配平后MnO2与O2的化学计量数比为2:1,采用对空气加压的方法可以提高MnO2的利用率,原因是加压增大氧气的浓度,反应速率加快,使MnO2反应更充分。
(2)滤渣Ⅱ是Al(OH)3、H2SiO3;,第一次通CO2不能用稀硫酸代替,这是由于稀硫酸酸性强,可溶解Al(OH)3,不易控制稀硫酸的用量,溶液中便会再次混入Al3+;
(3)第二次通入过量CO2生成MnO2,溶液中原先是K2MnO4,第二次通入过量的CO2时发生歧化反应生成MnO2和KMnO4,此时CO2被转化为HCO3-,反应为氧化还原反应,则反应的离子方程式为:3MnO42-+4CO2+2H2O=MnO2↓+2MnO4-+4HCO3-。
(4)将滤液Ⅲ进行一系列操作得KMnO4,此时溶液中还存在KHCO3,根据溶解度随温度变化的图象分析,随着温度升高,二者溶解度均不断增大,在40℃附近时二者溶解度相等,超过这一温度时,KHCO3溶解度不断增大,KMnO4溶解度则增大较缓慢,所以从溶液中提取较纯的KMnO4,需要蒸发结晶,趁热过滤,洗涤等操作。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:
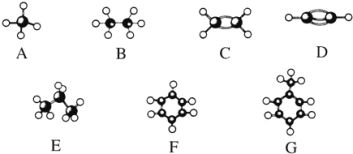
(1)E的一氯取代物同分异构有_______种。
(2)一卤代物种类最多的是________。(请填字母,下同)
(3)能够与Br2发生加成反应的两种气态烃是________。
(4)能够与酸性高锰酸钾反应的烃是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H等8种物质存在如下转化关系(反应条件,部分产物为标出).已知: A 是酸式盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题:

(1)写出下列物质的化学式:A________,B________,写出B的一种危害__________。
(2)写出下列反应的化学方程式:E→F____________;红热的木炭与D的浓溶液反应的方程式:____________;铜与H的浓溶液反应的离子方程式:_____________。
(3)检验某溶液中是否含A 中阳离子的方法_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂联合生产等都是很好的“低碳”生产方式。下面是几家工厂利用废气、废液、废渣联合生产化肥硫酸铵的工艺:
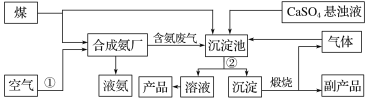
请回答下列问题:
(1)操作②为______________________________________________________。
(2)工业合成氨的化学方程式为_____________________。
(3)沉淀池中生成硫酸铵的化学方程式________________________________________。
(4)在实验室中检验氨气的方法是_________________________________。
(5)副产品的化学式为________。该联合生产工艺中可以循环使用的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中:①MgCl2 ②金刚石 ③Na2O2 ④H2O ⑤NaCl ⑥Ne ⑦H2SO4 ⑧NH4Cl ⑨CO2 ⑩O2
只含离子键的是_______________,只含共价键的是_______________,
既含离子键又含共价键的是_______________,不存在化学键的是______________,
属于离子化合物的是______________,属于共价化合物的是____________________。
(2)已知拆开1 mol H—H键、1 mol N≡N键、1 mol N—H键分别需要吸收的能量为436 kJ、946 kJ、391 kJ,则1 mol NH3分解为N2和H2时,该反应需要___________(填“放出”或“吸收”)______kJ的热量。
(3)将1 mol N2和3 mol H2充入密闭容器中,在一定条件下发生反应N2+3H2![]() 2NH3,下列说法正确的是________。
2NH3,下列说法正确的是________。
a.最终生成2 mol NH3b.可逆反应达到平衡时,反应停止
c.当v正(H2)=v逆(N2)时,反应达到平衡
d.达到平衡时,反应达到了最大限度
e.平衡时各组分的物质的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
选项 | 试剂 | 实验目的 | 实验装置 | ||
X | Y | Z |
| ||
A | MnO2 | 浓盐酸 | KI-淀粉溶液 | 比较Cl2与I2的氧化性强弱 | |
B | 石灰石 | 浓盐酸 | Na2SiO3溶液 | C元素非金属性大于Si元素 | |
C | 蔗糖 | 浓硫酸 | 溴水 | 证明浓硫酸具有脱水性、氧化性 | |
D | Na2SO3 | 稀HNO3 | 品红溶液 | 证明SO2具有漂白性 | |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型水系钠离子电池工作原理如图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4 还原为 Na2S。下列说法不正确的是

A. 充电时,太阳能转化为电能,电能又转化为化学能
B. M 是阴离子交换膜
C. 放电时,a 极为负极
D. 充电时,阳极的电极反应式为 3I--2e-=I3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物甲与乙在一定条件下可反应生成丙:

下列说法正确的是
A. 甲与乙生成丙的反应属于取代反应
B. 甲分子中所有原子共平面
C. 乙的一氯代物有2种
D. 丙在酸性条件下水解生成 和CH318OH
和CH318OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com