
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。

已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物 开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物 完全沉淀 | 3.2 | 9.0 | 6.7 |
(1)图中“试剂1”为________。
(2)加入CuO的作用是调节溶液pH,则pH的范围为________。
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中。其中,应先通入的气体是________(填代号及对应物质的化学式)。
(4)由溶液C获得CuCl2·3H2O,需要经过__________、________、过滤等操作。
(5)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2OCu(OH)2+2H+的平衡常数为________。
【解析】 (1)Fe2+开始沉淀时的pH为7.0,此时Cu2+已完全沉淀。所以欲除去Cu2+中混有的Fe2+时,必须先将其氧化为Fe3+。为避免引入新杂质,试剂1可以是氯气或H2O2。
(2)调节pH的原则是使Fe3+完全沉淀而Cu2+不沉淀。
(3)CO2在饱和食盐水中的溶解度小,因此必须先通入NH3。
(5)Cu2++2H2OCu(OH)2+2H+的平衡常数K=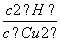 。根据Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)及常温下Kw=c(H+)·c(OH-)得:K=
。根据Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)及常温下Kw=c(H+)·c(OH-)得:K=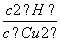 =
=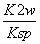 =
=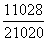 =5×10-9。
=5×10-9。
【答案】 (1)Cl2或H2O2
(2)3.2≤pH<4.7
(3)F——NH3
(4)蒸发浓缩 冷却结晶
(5)5×10-9


科目:高中化学 来源: 题型:
恒温下,反应aX(g)  bY(g) + cZ(g),达到平衡状态。若把容器的体积压缩到原来的
bY(g) + cZ(g),达到平衡状态。若把容器的体积压缩到原来的 ,达到平衡状态时,X的物质的量浓度从0.1mol/L增大到0.19mol/L。下列判断正确的是( )
,达到平衡状态时,X的物质的量浓度从0.1mol/L增大到0.19mol/L。下列判断正确的是( )
A.a>b+c B.a=b+c C.a<b+c D.a=b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
能说明氯的非金属性比硫强的事实是
A.氯气与氢气反应生成氯化氢,而硫与氢气反应生成硫化氢
B.向硫化氢的水溶液中通入氯气可得到淡黄色的硫
C.氯气能与水反应而硫不能
D.氯原子最外电子层上有7个电子而硫最外电子层上有6个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
结合短周期元素的性质用化学用语回答下列问题:
(1)与水反应最剧烈的金属是_____________。写出反应的离子方程式为_____________。(2)与水反应最剧烈的非金属单质是_____________。写出反应的化学方程式为_____________。
(3)最稳定的气态氢化物的化学式是_____________。
(4)除稀有气体外,原子半径最大的元素是_____,它与原子半径最小的元素形成的化合物属于 (离子、共价)化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子的浓度一定降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO )
)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是( )
A.全部 B.③⑤⑥
C.④⑤⑥ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
向2L密闭容器里充人2mol M和一定量的N,发生如下反应:M(g)+N(g)  E(g)当反应进行到4min时,测知M的浓度为0.2mol/L;反应进行到2min时,密闭容器中M的物质的量浓度为
E(g)当反应进行到4min时,测知M的浓度为0.2mol/L;反应进行到2min时,密闭容器中M的物质的量浓度为
A.等于0.6mol/L B.小于0.6mol/L
C.等于0.8mol/L D.大于0.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
向足量H2SO4溶液中加入100 mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为 ( )。
A.Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
(aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
B.Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-18 kJ·mol-1
(aq)===BaSO4(s) ΔH=-18 kJ·mol-1
C.Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-73 kJ·mol-1
(aq)===BaSO4(s) ΔH=-73 kJ·mol-1
D.Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-0.72 kJ·mol-
(aq)===BaSO4(s) ΔH=-0.72 kJ·mol-
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图所示装置可以模拟钢铁的电化学防护。下列说法正确的是
 A.若X为锌棒,开关K置于M处,铁极发生还原反应
A.若X为锌棒,开关K置于M处,铁极发生还原反应
B.若X为碳棒,开关K置于N处,X极发生还原反应
C.若X为碳棒,开关K置于N处,可加快铁的腐蚀
D.若X为锌棒,开关K置于M处,可加快铁的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g) △H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
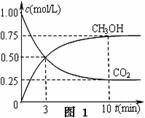
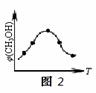
①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为
mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动。
②取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇的反应的△H3 0(填“>”、“<”或“=”)。
(3)脱硫。利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得。NaOH溶液吸收SO2的过程中,pH随n(SO32-)︰n(HSO3﹣)变化关系如下表:
| n(SO32﹣)︰n(HSO3﹣) | 91︰9 | 1︰1 | 9︰91 |
| pH | 8.2 | 7.2 | 6.2 |
① 由上表判断,NaHSO3溶液显 性, 用化学平衡原理解释: 。
② 当溶液呈中性时,离子浓度关系正确的是(选填字母): 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+) > c(HSO3-) > c(SO32-) > c(H+) = c(OH-)
c.c(Na+) + c(H+) = c(SO32-) + c(HSO3-) + c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com