
【题目】用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
A.标准状况下,22.4LH2O含有的分子数为NA
B.常温常压下,1.06gNa2CO3含有的Na+数为0.02NA
C.1mol甲烷的质量与甲烷的摩尔质量相等
D.16g水中所含的电子数为10NA
科目:高中化学 来源: 题型:
【题目】100 ℃时向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2,下列叙述不正确的是( )
A. 此时水的离子积Kw=1.0×10-12
B. 溶液中水电离出的c(H+)=1.0×10-10mol·L-1
C. 水的电离度随温度升高而增大
D. c(H+)<c(SO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是( )
A.工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
B.H2、I2、HI混合气体加压后颜色变深
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种不同条件下,分别向容积为1L的恒容密闭容器中充入4molA和2molB,发生反应:2A(g)+B(g)![]() 2D(g) △H=QkJ/mol,相关条件和数据见表。下列说法正确的是( )
2D(g) △H=QkJ/mol,相关条件和数据见表。下列说法正确的是( )
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
n(D)平衡/mol | 3 | 3 | 2 |
化学平衡常数 | K1 | K2 | K3 |
A.实验Ⅲ达平衡后,恒温下再向容器中通入2 molA和2 molD,平衡正向移动
B.升高温度能加快反应速率的原理是降低了活化能,使活化分子百分数提高
C.实验Ⅰ达平衡后容器内的压强是实验Ⅲ的0.9倍
D.K3<K2 =K1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中正确的是
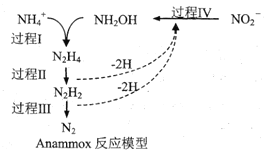
A.1molNH4+所含的质子总数为10NA(设NA为阿伏加德罗常数的值)
B.该方法每处理1molNH4+,需要0.5molNO2-
C.过程IV中,NO2-发生氧化反应
D.N2H2中含有σ键和π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mL5mol/L稀硝酸中加入19.2g铜粉,待充分反应,判断下列说法正确的是(忽略反应前后溶液体积的变化)( )
A.反应中转移电子的物质的量为0.6NA
B.标准状况下,产生NO2气体的体积为4.48L
C.反应后,H+的物质的量浓度为1.0mol/L
D.被还原的HNO3的物质的量为0.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图:

(1)基态Zn2+的价电子排布式为__;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是__。
(2)甘氨酸(H2N-CH2-COOH)中N的杂化轨道类型为__;甘氨酸易溶于水,试从结构角度解释__。
(3)一水合甘氨酸锌中Zn2+的配位数为__。
(4)[Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1molIMI中含有__σ键。
,则1molIMI中含有__σ键。
(5)常温下IMI的某种衍生物与甘氨酸形成的离子化合物为液态而非固态,原因是__。

(6)Zn与S形成某种化合物的晶胞如图Ⅰ所示。
①Zn2+填入S2-组成的__空隙中(填“四面体”或“八面体”);
②由图不能判断出S2-、Zn2+相切,若要使S2-、Zn2+相切,则Zn2+半径为__pm,已知晶体密度为dg/cm3,S2-半径为apm。(写计算表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用如图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)。
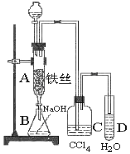
(1)写出A中反应的化学方程式_____。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是____。
(3)C中盛放CCl4的作用是___。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入___,现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com