
����Ŀ����3�ֲ�ͬ�����£��ֱ����ݻ�Ϊ1L�ĺ����ܱ������г���4molA��2molB��������Ӧ��2A(g)+B(g)![]() 2D(g) ��H��QkJ/mol��������������ݼ���������˵����ȷ���ǣ� ��
2D(g) ��H��QkJ/mol��������������ݼ���������˵����ȷ���ǣ� ��
ʵ���� | ʵ��� | ʵ��� | ʵ��� |
��Ӧ�¶�/�� | 700 | 700 | 750 |
��ƽ��ʱ��/min | 40 | 5 | 30 |
n(D)ƽ��/mol | 3 | 3 | 2 |
��ѧƽ�ⳣ�� | K1 | K2 | K3 |
A.ʵ����ƽ�����������������ͨ��2 molA��2 molD��ƽ�������ƶ�
B.�����¶��ܼӿ췴Ӧ���ʵ�ԭ���ǽ����˻�ܣ�ʹ����Ӱٷ������
C.ʵ����ƽ��������ڵ�ѹǿ��ʵ����0.9��
D.K3<K2 =K1
���𰸡�D
��������
Aѡ�ʵ������ƽ�����������������ͨ��2 molA��2 molD����Ҫ����Ũ���̺�ƽ�ⳣ���Ĵ�С��
2A(g) + B(g)![]() 2D(g)
2D(g)
��ʼ�� 4mol 2mol 0
ת���� 2mol 1mol 2 mol
ƽ���� 2mol 1mol 2 mol
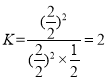 ��
��
������������ͨ��2 molA��2 molD����ʱ���ʵ����ֱ�Ϊ4 molA��1 molA ��4 molD��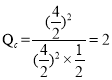
��K=Qc�����ƽ�ⲻ�ƶ�����A����
Bѡ������¶��ܼӿ췴Ӧ���ʵ�ԭ��������������ԭ�����ǻ���ӱ�Ϊ�˻���ӣ�����Ӱٷ�����ߣ���ײƵ�����ӣ����ʼӿ죬��B����
Cѡ�����PV=nRT���ó�![]() ��
��
��ʵ�����У�
2A(g) + B(g)![]() 2D(g)
2D(g)
��ʼ�� 4mol 2mol 0
ת���� 3mol 1.5mol 3 mol
ƽ���� 1mol 0.5mol 3 mol
��ʵ�����У�
2A(g) + B(g)![]() 2D(g)
2D(g)
��ʼ�� 4mol 2mol 0
ת���� 2mol 1mol 2 mol
ƽ���� 2mol 1mol 2 mol
![]() ,
,
��C����
Dѡ��¶����ߣ������ȷ����ƶ���D�����ʵ������٣�˵��ƽ�������ƶ������������ȷ�Ӧ��K3<K2 =K1����D��ȷ��
������������ΪD



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D������ѧ��ѧ�г������ʣ�����A��B��C������ͬһ��Ԫ�أ���һ���������ת����ϵ����(���ַ�Ӧ�е�ˮ����ȥ)����������ش��������⣺

��1����A��B��C����ɫ��Ӧ��Ϊ��ɫ��CΪ�����е���Ʒ��D�Ĺ����ŷŻ��������ЧӦ��
��A�Ļ�ѧʽ______________��B������____________��
�ڷ�ӦII�����ӷ���ʽ��__________________________________��
��2����A��D��Ϊ���ʣ���AΪ���壬DԪ�ص�һ�ֺ���ɫ�����ﳣ�������ϡ�
�ٷ�ӦII�����ӷ���ʽ��_____________________________��
�ڷ�Ӧ������ӷ���ʽ��_____________________________��
�ۼ���B����������õķ�����_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ӻ���MCl(s)��ˮ���ܽⲢ�������룬�ù��̵���ʾ��ͼ��ͼ����֪NAΪ����٤��������ֵ���������˵����ȷ���ǣ� ��
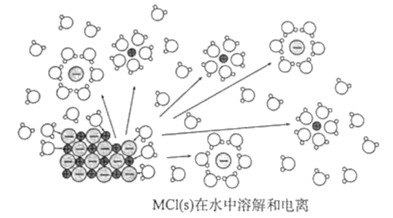
A.1molMCl�к���NA�Թ��õ��Ӷ�
B.MClΪ������ʣ���ˮ�н����ֵ���
C.M+��Cl-����ˮ�����е���ԭ�ӽ���γ�ˮ������
D.MCl��ˮ�����µ��ܽ�͵�������������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ǻ��Ұ���HOCH2CH2NH2)�͵����ض�����Ԫ�أ�����;�dz��㷺���ش��������⣺
��1����̬��ԭ�Ӽ۲�����Ų�ͼΪ___�����е���������ߵ��ܼ���___��
��2��HOCH2CH2NH2�����ǽ���Ԫ�ص縺���ɴ�С˳��Ϊ___������C��N���ӻ���ʽ��Ϊ___HOCH2CH2NH2�С�HOCС�ڡ�HNC����ԭ����___��
��3��HOCH2CH2NH2��һ�ֳ����Ķ������壬�ܺ�Co2+�γɻ�״�����ӡ�Coλ��Ԫ�����ڱ���___�����û�״�����ӵ���λԭ��Ϊ___��
��4��������Ϊ������������ṹ��ͼ������Ga���������ܶѻ���Ga�����NΧ�ɵ�___��ѡ��������϶�����������϶���������϶�������ο�϶������֪�þ����ױ߱߳�Ϊapm����Ϊcpm�������ӵ�������ֵΪNA����þ�����ܶ�Ϊ___gcm-3(�г�����ʽ���ɣ���
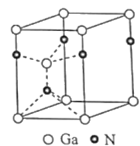
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ������ʵ�����ʵ����ƣ����в��ܴﵽ��Ӧ��ʵ��Ŀ�ĵ��ǣ� ��
ѡ�� | ʵ��Ŀ�� | ʵ����� |
A | ��ȥ���������е����� |
|
B | ֤�������ԣ�Cl2>I2 |
|
C | ��NaOH����Һ�ζ�ijϡ���� |
|
D | ̽����¯���ˮ����Ʒ�����е��ܽ� |
|
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��г�������111��Ԫ����Ԫ�����ڱ��е�λ��:
�� ���ڡ� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 | |||
һ | �� | ||||||||||
�� | �� | �� | �� | �� | |||||||
�� | �� | �� | �� | �� | �� | ||||||
�� | |||||||||||
�밴Ҫ��ش��������⣺
��1��д��Ԫ�آ��γɵ��ʵĵ���ʽ______________
��2������11��Ԫ���У��ǽ�������ǿ��Ԫ�ص�ԭ�ӽṹʾ��ͼ________________
��3��Ԫ�آݢܢ�ֱ�͢��γɵ����廯�����У����ȶ����ǣ������Ļ�ѧʽ��__________
��4��Ԫ�آ��������������ˮ�����У�������ǿ���ǣ������Ļ�ѧʽ��___________
��5����ʢ��ˮ��С�ձ��м���Ԫ�آ�ĵ��ʣ�������Ӧ�����ӷ���ʽ____________________
��6�����ԭ�ӽṹ�ĽǶȽ��ͣ�����Ԫ�آ�ķǽ����Ա�Ԫ��ǿ��ԭ��_______________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ���������ֵ������������ȷ���ǣ� ��
A.��״���£�22.4LH2O���еķ�����ΪNA
B.���³�ѹ�£�1.06gNa2CO3���е�Na+��Ϊ0.02NA
C.1mol���������������Ħ���������
D.16gˮ�������ĵ�����Ϊ10NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����H2(g)��![]() O2(g)=H2O(g) ��H1��akJ��mol1
O2(g)=H2O(g) ��H1��akJ��mol1
��2H2(g)��O2(g)=2H2O(g) ��H2��bkJ��mol1
��H2(g)��![]() O2(g)=H2O(l) ��H3��ckJ��mol1
O2(g)=H2O(l) ��H3��ckJ��mol1
��2H2(g)��O2(g)=2H2O(l) ��H4��d kJ��mol1
���й�ϵʽ����ȷ����
A.a<c<0B.b>d>0C.2a��b<0D.2c��d>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ�ÿ������ռ����岢��֤��ijЩ��ѧ�����ܴﵽĿ����
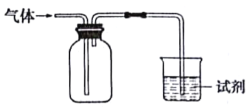
ѡ�� | ���� | �Լ� | ���� | ���� |
A | NH3 | ��̪��Һ | ��Һ���ɫ | ��ˮ�Լ��� |
B | Cl2 | ��ɫʯ����Һ | ��Һ�ȱ�����ɫ | Cl2�����Ժ�Ư���� |
C | C2H4 | ��ˮ | ��Һ��ɫ | C2H4�����к�̼̼˫�� |
D | X | KI������Һ | ��Һ���� | X������NO2 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com