
【题目】常温下,向20mL![]()
![]()
![]() 溶液中逐滴加入
溶液中逐滴加入![]()
![]() HCl溶液40mL,溶液中含碳元素的各种微粒
HCl溶液40mL,溶液中含碳元素的各种微粒![]() 逸出未画出
逸出未画出![]() 的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是
的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是![]()
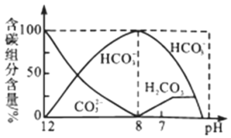
A.在同一溶液中,![]() 、
、![]() 、
、![]() 不能大量共存
不能大量共存
B.已知在![]() ,
,![]() 的水解平衡常数
的水解平衡常数![]() ,当溶液的
,当溶液的![]() 时,溶液中
时,溶液中![]() :
:![]() :1
:1
C.![]() 时溶液中各种离子其物质的量浓度的大小关系是
时溶液中各种离子其物质的量浓度的大小关系是![]()
D.当混合液![]() 时,开始放出
时,开始放出![]() 气体
气体
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】t℃时,AgCl(s)与AgI(s)分别在溶液中达到沉淀溶解平衡,相关离子浓度的关系如下图所示。下列说法正确的是

A. 曲线Y表示![]() 与
与![]() 的变化关系
的变化关系
B. t℃时,向Z点对应的溶液中加入蒸馏水,可使溶液变为曲线X对应的饱和溶液
C. t℃时,AgCl(s)+I-(aq)![]() AgI(s)+Cl-(aq)的平衡常数K=1×106
AgI(s)+Cl-(aq)的平衡常数K=1×106
D. t℃时,向浓度均为0.1mol/ L的KI与KCl混合溶液中加入AgNO3溶液,当Cl-刚好完全沉淀时,此时c(I-) = 1×10-5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol·L-1的H2A溶液中各种微粒浓度的对数值(lgc)与pH的关系如图所示。
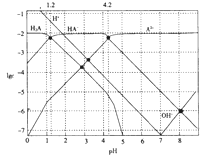
下列说法不正确的是
A. H2A是二元弱酸
B. HA-![]() H++A2-的电离平衡常数Ka=10-12
H++A2-的电离平衡常数Ka=10-12
C. 0.1mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D. pH=4.2 时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和甲烷催化合成CO和H2是CO2资源化利用的有效途径。主要反应如下:
Ⅰ:CH4(g)+CO2(g)2CO(g)+2H2(g) △H=+247kJ/mol
(1)已知CH4(g)+H2O(g)CO(g)+3H2(g) △H=+206 kJ/mol
写出CH4和水蒸气反应生成CO2的热化学方程式:___。
(2)在恒温、恒容的密闭容器中发生反应Ⅰ,下列选项能够说明反应Ⅰ达到平衡状态的是___。
A.混合气体的密度不变
B.混合气体的总压强不变
C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2
D.2v正(H2)=v逆(CH4)
E.混合气体的平均相对分子质量不变
(3)催化合成的温度通常维持在550﹣750℃之间,从反应速率角度分析其主要原因可能是___。
(4)将CH4与CO2各1mol充入某密闭容器中,发生反应Ⅰ。100kPa时,反应Ⅰ到达平衡时CO2的体积分数与温度的关系曲线如图所示。
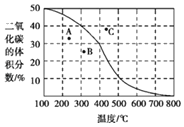
①图中A、B、C三点表示不同温度、压强下达到平衡CO2的体积分数,则___点对应的平衡常数最小,判断依据是___;___点对应的压强最大。
②300℃、100kPa下,该容器中反应Ⅰ经过40min达到平衡,计算反应在0﹣40 min内的平均反应速率为v(CO2)=___mol/min(用分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以![]() 、
、![]() 为电解质,以
为电解质,以![]() 为燃料,该电池工作原理如图。下列说法正确的是
为燃料,该电池工作原理如图。下列说法正确的是
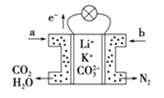
A.a为![]() ,b为
,b为![]()
B.在熔融电解质中,![]() 向正极移动
向正极移动
C.此电池在常温时也能工作
D.通入丁烷的一极是负极,电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是
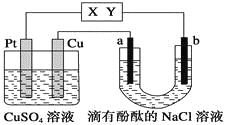
A.X极是电源的负极,Y极是电源的正极
B.Cu电极上增重6.4 g时,b极产生4.48 L(标准状况)气体
C.电解过程中CuSO4溶液的pH逐渐增大
D.a极的电极反应式为2Cl--2e-=== Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于水的电离平衡的相关说法正确的是
A.c(H+)=![]() 的溶液一定呈中性
的溶液一定呈中性
B.将水加热,Kw增大,pH增大,呈碱性
C.向水中加入少量硫酸氢钠固体,溶液的c(H+)增大,平衡逆向移动,Kw减小
D.向0.1 mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com