
【题目】CO2和甲烷催化合成CO和H2是CO2资源化利用的有效途径。主要反应如下:
Ⅰ:CH4(g)+CO2(g)2CO(g)+2H2(g) △H=+247kJ/mol
(1)已知CH4(g)+H2O(g)CO(g)+3H2(g) △H=+206 kJ/mol
写出CH4和水蒸气反应生成CO2的热化学方程式:___。
(2)在恒温、恒容的密闭容器中发生反应Ⅰ,下列选项能够说明反应Ⅰ达到平衡状态的是___。
A.混合气体的密度不变
B.混合气体的总压强不变
C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2
D.2v正(H2)=v逆(CH4)
E.混合气体的平均相对分子质量不变
(3)催化合成的温度通常维持在550﹣750℃之间,从反应速率角度分析其主要原因可能是___。
(4)将CH4与CO2各1mol充入某密闭容器中,发生反应Ⅰ。100kPa时,反应Ⅰ到达平衡时CO2的体积分数与温度的关系曲线如图所示。
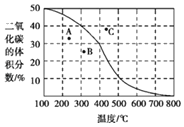
①图中A、B、C三点表示不同温度、压强下达到平衡CO2的体积分数,则___点对应的平衡常数最小,判断依据是___;___点对应的压强最大。
②300℃、100kPa下,该容器中反应Ⅰ经过40min达到平衡,计算反应在0﹣40 min内的平均反应速率为v(CO2)=___mol/min(用分数表示)。
【答案】CH4(g)+2H2O(g)CO2(g)+4H2(g) △H=+165kJ/mol BE 在该温度范围内,催化剂的活性较高,反应速率较快 A 反应Ⅰ为吸热反应,温度越低,平衡常数越小 C ![]()
【解析】
(1)利用盖斯定律计算焓变;
(2)未达到平衡状态时体系中某些值是不断变化的,当这些值不变时可说明反应达到平衡状态;
(3)催化剂的活性大小是与温度有关;
(4)①平衡常数只与温度有关;
②根据题目所给单位mol/min可知本题中反应速率是指单位时间内物质的量的变化;
(1)由①2CO(g)+2H2 (g)CH4(g)+CO2(g) △H=﹣247kJ/mol
②2CH4(g)+2H2 O(g)2CO(g)+6H2(g) 2△H=+2×206kJ/mol
结合盖斯定律可知,①+②得到CH4(g)+2H2O(g)CO2(g)+4H2(g)△H=+165kJ/mol,故答案为:CH4(g)+2H2O(g)CO2(g)+4H2(g)△H=+165kJ/mol;
(2)A.该反应反应物和生成物都是气态物质,所以根据质量守恒定律可知气态物质的质量没变,又是恒容,体积没变,则密度是恒定的,故A错误;
B.由于反应前后气体体积不同,所以压强是一个变量,“变量不变”则说明达到了平衡状态,故B正确;
C.平衡状态是物质的量保持不变,不是成比例或者相等,故C错误;
D.达到平衡状态时同一物质的正逆反应速率相等,不同物质的正逆反应速率与化学计量数成正比,应该是v(H2)=2v(CH4),故D错误;
E.由于根据质量守恒定律可知,气体总质量不变,反应前后气体体积改变,所以混合气体的平均相对分子质量在反应过程中是一个变量,现在保持不变,可以判断达到平衡状态,故E正确;
故答案为:BE;
(3)催化剂的活性大小是与温度有关的,故要想达到使催化剂达到最大活性则需要有适宜温度范围,故答案为:在该温度范围内,催化剂的活性较高,反应速率较快;
(4)①该反应焓变值大于零,为吸热反应,温度升高,向正反应方向移动,平衡常数变大,反之温度越低平衡常数越小,A点温度最低,故A点对应平衡常数最小。该反应的正反应为气体体积增大的反应,温度升高,反应向正向移动,气体体积增大,由于是恒容容器,故气体体积增大,压强也增大,C点温度最高,故C点对应压强最大,故答案为:A;反应Ⅰ为吸热反应,温度越低,平衡常数越小;C;
②由图可知:在300℃、100kPa时二氧化碳的体积分数40%。
设在300℃、100kPa条件下,达到平衡时消耗二氧化碳的物质的量为xmol。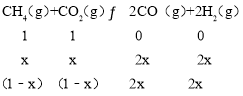
则平衡时,混合气体总的物质的量n(混)=(1﹣x)+(1﹣x)+2x+2x=(2+2x)mol
则CO2体积分数=![]() =
=![]() ×100%=40%,可得x=
×100%=40%,可得x=![]() ,则v(CO2)=
,则v(CO2)=![]() =
=![]() mol/min=
mol/min=![]() mol/min。
mol/min。
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | 酸的强弱:HX<HY |
B | 向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
C | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
D | 常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH | pH:NaA>NaB | 常温下酸性:HA﹤HB |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图(不考虑电极产物的溶解),则下列说法正确的是( )
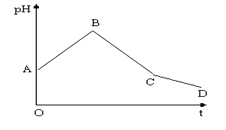
A.阳极产物一定是Cl2,阴极产物一定是Cu
B.整个过程中阳极先产生Cl2,后产生O2
C.BC段表示在阴极上是H+放电产生了H2
D.CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是 ( )
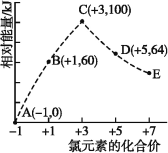
A.这些离子中结合H+能力最强的是A
B.A、B、C、D、E五种微粒中C最稳定
C.C→B+D的反应,反应物的总键能小于生成物的总键能
D.B→A+D反应的热化学方程式为3ClO-(aq)=ClO3- (aq)+2Cl-(aq) ΔH=+116 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
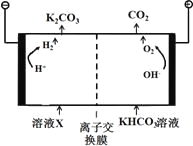
(1)在阳极区发生的反应包括_____________和H ++ HCO3-=H2O + CO2↑。
(2)简述CO32-在阴极区再生的原理_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL![]()
![]()
![]() 溶液中逐滴加入
溶液中逐滴加入![]()
![]() HCl溶液40mL,溶液中含碳元素的各种微粒
HCl溶液40mL,溶液中含碳元素的各种微粒![]() 逸出未画出
逸出未画出![]() 的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是
的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是![]()
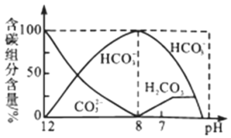
A.在同一溶液中,![]() 、
、![]() 、
、![]() 不能大量共存
不能大量共存
B.已知在![]() ,
,![]() 的水解平衡常数
的水解平衡常数![]() ,当溶液的
,当溶液的![]() 时,溶液中
时,溶液中![]() :
:![]() :1
:1
C.![]() 时溶液中各种离子其物质的量浓度的大小关系是
时溶液中各种离子其物质的量浓度的大小关系是![]()
D.当混合液![]() 时,开始放出
时,开始放出![]() 气体
气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的各图中,表示2A(g)+B(g)2C(g)(△H<0)这个可逆反应的正确图象为(注:(C)表示C的质量分数,P表示气体压强,C表示浓度)
A.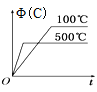 B.
B.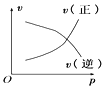 C.
C.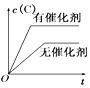 D.
D.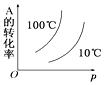
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是![]()
A.硬脂酸与乙醇的酯化反应:![]()
![]()
![]()
B.常温时,![]() 氨水的
氨水的![]() :
:![]()
C.由Na和Cl形成离子键的过程:![]()
![]()
![]()
D.电解精炼铜的阴极反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少汽车尾气造成环境污染的方法之一是在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧和SO2的转化。
(1)写出CO与NO反应的化学方程式:________________。
(2)“催化转化器”的缺点是在一定程度上提高空气的酸度,其原因是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com