
【题目】减少汽车尾气造成环境污染的方法之一是在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧和SO2的转化。
(1)写出CO与NO反应的化学方程式:________________。
(2)“催化转化器”的缺点是在一定程度上提高空气的酸度,其原因是___________。
【答案】2CO+2NO![]() 2CO2+N2 SO2转化为SO3,产生了硫酸酸雾
2CO2+N2 SO2转化为SO3,产生了硫酸酸雾
【解析】
(1)在催化剂作用下,一氧化氮和一氧化碳反应生成可参与大气生态环境循环的无毒的氮气和二氧化碳;
(2)由于“催化转化器”促进了SO2与空气中氧气反应生成SO3,SO3与H2O生成趋势H2SO4。
(1)在催化剂作用下,一氧化氮和一氧化碳反应生成可参与大气生态环境循环的无毒的氮气和二氧化碳,反应的化学方程式为2CO+2NO![]() 2CO2+N2,故答案为:2CO+2NO
2CO2+N2,故答案为:2CO+2NO![]() 2CO2+N2;
2CO2+N2;
(2)由于“催化转化器”促进了SO2与空气中氧气反应生成SO3,SO3与H2O生成趋势H2SO4,提高了空气的酸度,故答案为:SO2转化为SO3,产生了硫酸酸雾。


科目:高中化学 来源: 题型:
【题目】CO2和甲烷催化合成CO和H2是CO2资源化利用的有效途径。主要反应如下:
Ⅰ:CH4(g)+CO2(g)2CO(g)+2H2(g) △H=+247kJ/mol
(1)已知CH4(g)+H2O(g)CO(g)+3H2(g) △H=+206 kJ/mol
写出CH4和水蒸气反应生成CO2的热化学方程式:___。
(2)在恒温、恒容的密闭容器中发生反应Ⅰ,下列选项能够说明反应Ⅰ达到平衡状态的是___。
A.混合气体的密度不变
B.混合气体的总压强不变
C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2
D.2v正(H2)=v逆(CH4)
E.混合气体的平均相对分子质量不变
(3)催化合成的温度通常维持在550﹣750℃之间,从反应速率角度分析其主要原因可能是___。
(4)将CH4与CO2各1mol充入某密闭容器中,发生反应Ⅰ。100kPa时,反应Ⅰ到达平衡时CO2的体积分数与温度的关系曲线如图所示。
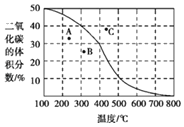
①图中A、B、C三点表示不同温度、压强下达到平衡CO2的体积分数,则___点对应的平衡常数最小,判断依据是___;___点对应的压强最大。
②300℃、100kPa下,该容器中反应Ⅰ经过40min达到平衡,计算反应在0﹣40 min内的平均反应速率为v(CO2)=___mol/min(用分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国尿素合成塔(尿塔)使用寿命仅为欧美国家的1/4。为此北京钢铁研究院对某尿塔腐蚀过程进行研究,得出下列腐蚀机理:
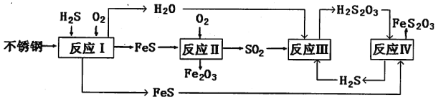
(1)H2S来自合成尿素的天然气。在380K、体积为2L的密闭容器中,存在反应:H2(g)+S(s)![]() H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
①380K时该反应的化学平衡常数为__________。
②下列对该反应分析正确的是_________(填序号)。
(2)反应II的化学方程式为:____________________________________。
(3)已知室温下H2S2O3:K1=2.2×10-1,K2=2.5×10-2。
①Na2S2O3水溶液中电荷守恒式为___________________________;
②反应IV的化学方程式_____________________________________。该反应_________(填“能”或“不能”)说明FeS溶解性强于FeS2O3。
(4)此尿塔的最终腐蚀产物为__________________。为了有效防腐,北钢建议该尿塔在生产中用CuSO4溶液“脱硫(H2S)”,离子反应方程式为_________。(室温下,H2S:K1=1.3×10-7、K2=7.1×10-15。CuS:Ksp=6.3×10-36)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.![]() 可表示单核10电子粒子基态时的电子排布
可表示单核10电子粒子基态时的电子排布
B.电子仅在激发态跃迁到基态时才会产生原子光谱
C.同一原子能层越高,s电子云的半径越大
D.N、O、F电负性逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计了下图所示的电化学装置,电极I为锌,其他电极均为石墨,盐桥是浸泡了饱和氯化钾溶液的琼脂,丙池是滴加了酚酞的氯化钠溶液。下列叙述正确的是( )

A.电子由电极IV通过外电路流向电极I
B.装置工作过程中III电极周围出现红色
C.电极II发生还原反应
D.盐桥中Cl-向乙池移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于水的电离平衡的相关说法正确的是
A.c(H+)=![]() 的溶液一定呈中性
的溶液一定呈中性
B.将水加热,Kw增大,pH增大,呈碱性
C.向水中加入少量硫酸氢钠固体,溶液的c(H+)增大,平衡逆向移动,Kw减小
D.向0.1 mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及硼的化合物有着广泛的用途。请回答下列问题:

(1)硼在元素周期表中的位置为:____________________________________;
(2)硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图a是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,投影在同一平面上。根据图示确定硼化镁的化学式为_____________。
(3)硼酸(H3BO3),白色片状晶体,微溶于水,对人体的受伤组织有防腐消毒作用。H3BO3溶液中存在H3BO3(aq)+H2O(l)![]() [B(OH)4]-(aq)+H+(aq)的平衡。硼酸和过量的NaOH溶液反应方程式为:H3BO3+NaOH=Na[B(OH)4]。硼酸晶体具有层状结构,每一层结构如图1所示。
[B(OH)4]-(aq)+H+(aq)的平衡。硼酸和过量的NaOH溶液反应方程式为:H3BO3+NaOH=Na[B(OH)4]。硼酸晶体具有层状结构,每一层结构如图1所示。
①硼酸晶体属于_______晶体(填“离子”、“分子”或“原子”)。
②下列关于硼酸的说法正确的是_______________(填序号)。
a.H3BO3是一元酸
b.其水溶液中,水的电离平衡受到抑制
c.晶体中有氢键,因此硼酸分子较稳定
(4)三氟化硼(BF3)水解生成硼酸和氟硼酸(HBF4,强酸)。BF3分子立体构型为___________,BF4-的电子式____________。
(5)氨硼烷(NBH6)是一种有效、安全的固体储氢材料。氨硼烷的结构(如图b)和乙烷相似,氨硼烷分子与硼酸分子中硼原子的杂化轨道类型分别为:___________和___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种应用广泛的金属,在工业上用![]() 和冰晶石
和冰晶石![]() 混合熔电解制得。
混合熔电解制得。
Ⅰ.铝土矿的主要成分是![]() 和
和![]() 等。从铝土矿中提炼
等。从铝土矿中提炼![]() 的流程如下:
的流程如下:

(1)写出反应1中涉及的任意一个化学方程式______;
(2)滤液Ⅰ中加入的CaO生成的沉淀是_____,已知气体A在标准状况下的密度为1.96g/L,反应2的离子方程式为______;
Ⅱ.以萤石![]() 和纯碱为原料制备冰晶石的流程如下:
和纯碱为原料制备冰晶石的流程如下:

(3)萤石![]() 的电子式______;
的电子式______;
(4)若E为硫酸钙,D为最稳定的气态氢化物,则化合物C是______,写出由D制备冰晶石![]() 的化学方程式_______;
的化学方程式_______;
(5)工业电解制铝若以石墨为电极,阳极产生的混合气体的成分是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是我们已经学过的烷烃或烯烃的化学反应,请写出其反应的化学方程式,指出反应类型.
(1)乙烷与氯气生成一氯乙烷的反应:________________________________________________________,__________________。
(2)乙烯与溴水的反应:_______________________________________________,
________。
(3)乙烯与水的反应:__________________________________________________,
________.
(4)乙烯生成聚乙烯的反应:_______________________________________________,
____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com