
����Ŀ���й����غϳ���(����)ʹ��������Ϊŷ�����ҵ�1/4��Ϊ�˱��������о�Ժ��ij������ʴ���̽����о����ó����и�ʴ������
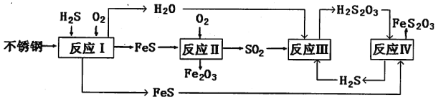
(1)H2S���Ժϳ����ص���Ȼ������380K�����Ϊ2L���ܱ������У����ڷ�Ӧ��H2(g)��S(s)![]() H2S(g) ��H����21.6 kJ��mol��1����Ӧ�ﵽƽ��ʱ��H2��S��H2S�����ʵ�����Ϊ3 mol��
H2S(g) ��H����21.6 kJ��mol��1����Ӧ�ﵽƽ��ʱ��H2��S��H2S�����ʵ�����Ϊ3 mol��
��380Kʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ__________��
�����жԸ÷�Ӧ������ȷ����_________(�����)��
(2)��ӦII�Ļ�ѧ����ʽΪ��____________________________________��
(3)��֪������H2S2O3��K1��2.2��10��1��K2��2.5��10��2��
��Na2S2O3ˮ��Һ�е���غ�ʽΪ___________________________��
�ڷ�ӦIV�Ļ�ѧ����ʽ_____________________________________���÷�Ӧ_________(������������������)˵��FeS�ܽ���ǿ��FeS2O3��
(4)�����������ո�ʴ����Ϊ__________________��Ϊ����Ч���������ֽ������������������CuSO4��Һ������(H2S)�������ӷ�Ӧ����ʽΪ_________��(�����£�H2S��K1��1.3��10��7��K2��7.1��10��15��CuS��Ksp��6.3��10��36)
���𰸡�1 ab 4FeS��7O2��2Fe2O3��4SO2 c(Na��)��c(H��)��2c(S2O32��)��c(HS2O3��)��c(OH��) FeS��H2S2O3��H2S����FeS2O3 ���� Fe2O3��FeS2O3 Cu2����H2S��CuS����2H��
��������
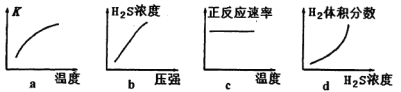
����ƽ�ⳣ���Ĺ�ʽ���м��㣬���岻���룻�÷�Ӧ����Ӧ�����ȷ�Ӧ���¶�����ƽ��������Ӧ�ƶ�������ѹǿƽ�ⲻ�ƶ��������������С�������Ũ�����������¶ȷ�Ӧ���ʼӿ죻���������Ũ�ȣ���ЧΪ����ѹǿ�����ݷ�Ӧ����ͼ��֪����ӦII��Ҫ��Ӧ����O2��FeS����Ҫ������SO2��Fe2O3���ٸ��ݵ�ʧ�����غ���ƽ���̣���ӦII�ͷ�ӦIV�����ղ�����Fe2O3��FeS2O3������������ͭ��Ӧ������ͭ���������ᣬ�൱��ǿ�����ķ�Ӧ��
(1) �ٸ���ƽ�ⳣ���Ĺ�ʽ���м��㣬���岻���룬�ʸ÷�Ӧ��ƽ�ⳣ��K= ![]() =
= ![]() =1���ڸ÷�Ӧ����Ӧ�����ȷ�Ӧ���¶�����ƽ��������Ӧ�ƶ���ƽ�ⳣ������ͼ����ʵ������ϣ�����ѹǿƽ�ⲻ�ƶ��������������С�������Ũ�����������¶ȷ�Ӧ���ʼӿ죬ͼ��������Ӧ���ʲ��䣻���������Ũ�ȣ���ЧΪ����ѹǿ��ƽ�ⲻ�ƶ�������ֵĺ������䣬ͼ����ʵ�ʲ������H2S2O3�������ᣬ����Һ�д��ڵ�������Na����H����S2O32����HS2O3����OH������ӦIV����Ҫ��Ӧ����H2S2O3��FeS����Ҫ������H2S��FeS2O3��
=1���ڸ÷�Ӧ����Ӧ�����ȷ�Ӧ���¶�����ƽ��������Ӧ�ƶ���ƽ�ⳣ������ͼ����ʵ������ϣ�����ѹǿƽ�ⲻ�ƶ��������������С�������Ũ�����������¶ȷ�Ӧ���ʼӿ죬ͼ��������Ӧ���ʲ��䣻���������Ũ�ȣ���ЧΪ����ѹǿ��ƽ�ⲻ�ƶ�������ֵĺ������䣬ͼ����ʵ�ʲ������H2S2O3�������ᣬ����Һ�д��ڵ�������Na����H����S2O32����HS2O3����OH������ӦIV����Ҫ��Ӧ����H2S2O3��FeS����Ҫ������H2S��FeS2O3��
�ʴ�Ϊ��1��ab��
(2)���ݷ�Ӧ����ͼ��֪����ӦII��Ҫ��Ӧ����O2��FeS����Ҫ������SO2��Fe2O3���ٸ��ݵ�ʧ�����غ���ƽ���̣��ɵã�4FeS��7O2��2Fe2O3��4SO2��
�ʴ�Ϊ��4FeS��7O2��2Fe2O3��4SO2��
(3)����غ㣺��Һ�����������ӵĵ�����������������ӵĸ���������ɵ���ƽ�ⳣ����֪��H2S2O3�������ᣬ����Һ�д��ڵ�������Na����H����S2O32����HS2O3����OH�������е���غ㣺c(Na��)��c(H��)��2c(S2O32��)��c(HS2O3��)��c(OH��)�����ݷ�Ӧ����ͼ��֪����ӦIV����Ҫ��Ӧ����H2S2O3��FeS����Ҫ������H2S��FeS2O3������д����ӦIV�Ļ�ѧ����ʽΪ��FeS��H2S2O3��H2S����FeS2O3ѧ���÷�Ӧ���ڸ��ֽⷴӦ������˵�����ߵ��ܽ�ȴ�С��
�ʴ�Ϊ��c(Na��)��c(H��)��2c(S2O32��)��c(HS2O3��)��c(OH��)�� FeS��H2S2O3��H2S����FeS2O3�����ܣ�
(4)������ͼ��֪����ӦII�ͷ�ӦIV�����ղ�����Fe2O3��FeS2O3���ʴ����������ո�ʴ����ΪΪFe2O3��FeS2O3������������ͭ��Ӧ������ͭ���������ᣬ�൱��ǿ�����ķ�Ӧ����Ӧ���ӷ���ʽΪ��Cu2++H2S=CuS��+2H+��
�ʴ�Ϊ��Fe2O3��FeS2O3��Cu2++H2S=CuS��+2H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪһ��������ˮ����װ�ã���װ�ÿ�����һ�����ォ�л���ˮ�Ļ�ѧ��ֱ��ת��Ϊ���ܣ���ͼ�Ǻ�Cr2O72-���Է�ˮ�Ĵ���װ�á����ס�����װ������[Fe(��)����X������]���ɽ�Cr2O72-ת����Cr(OH)3��������ȥ������˵���������
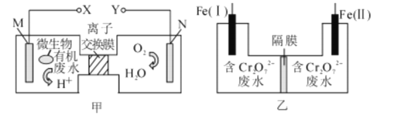
A.����ˮ�к�����ȩ����M���ĵ缫��ӦΪ��CH3CHO��2H2O��8e��=2CO2����8H����
B.���һ��ʱ�����Fe(I)�������г�������
C.װ���ҵĸ�Ĥ�������ӽ���Ĥ
D.��·��ÿת��3 mol���ӣ������0.5 mol Cr2O72-����ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�صĻ��ϼ��Ʋ����ʵ������ǻ�ѧ�о�����Ҫ�ֶΡ���ͼ����Ԫ�صij������ϼ��벿���������Ķ�Ӧ��ϵ��
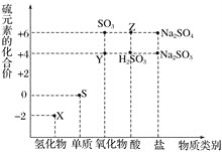
(1)����Ԫ�ػ��ϼ۱仯�ĽǶȷ�����ͼ�м������������л�ԭ�ԵĻ�������_______________(�ѧʽ)��
(2)��X��Y��ϣ������ɵ���ɫ���塣�÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ_____________��
(3)��������Y�ķ�����______________________________��
(4)Z��Ũ��Һ��ͭ������һ�������¿��Է�����ѧ��Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ____________��
(5)Na2S2O3����Ҫ�Ļ���ԭ�ϣ���������ԭ��Ӧ�ĽǶȷ����������Ʊ�Na2S2O3�ķ��������Ͽ��е���_____________(����ĸ)��
a��Na2S��S b��Na2SO3��S
c��SO2��Na2SO4 d��Na2SO3��Na2SO4
(6)��֪Na2SO3�ܱ�K2Cr2O7����ΪNa2SO4����24mL 0.05mol��L-1��Na2SO3��Һ�� 20mL 0.02mol��L-1��K2Cr2O7��Һǡ�÷�Ӧʱ��CrԪ���ڻ�ԭ�����еĻ��ϼ�Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����пƬ��ͭƬ�õ������������ϡ������Һ�й���ԭ��ء�����������ȷ���ǣ� ��
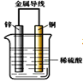
A. ��װ�ý���ѧ��ת��Ϊ����
B. ������пƬ����ͭƬ
C. һ��ʱ���ͭƬ��������
D. пƬ������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪þ�ֱܷ���O2��N2��CO2��Ӧ����Ӧ�Ļ�ѧ����ʽ�ֱ��� 2Mg��O2![]() 2MgO��3Mg��N2
2MgO��3Mg��N2![]() Mg3N2��2Mg��CO2
Mg3N2��2Mg��CO2![]() 2MgO��C���ѵ������Ľ���þ�ֱ���ڣ��������������У�������������̼�����У������������У���ȫȼ�պõ��Ĺ������ʵ������ֱ��Ӧ����W1g��W2g��W3g���������ߵĹ�ϵ��ȷ���ǣ� ��
2MgO��C���ѵ������Ľ���þ�ֱ���ڣ��������������У�������������̼�����У������������У���ȫȼ�պõ��Ĺ������ʵ������ֱ��Ӧ����W1g��W2g��W3g���������ߵĹ�ϵ��ȷ���ǣ� ��
A.W1>W2>W3B.W3��W1>W2C.W3>W2>W1D.W2>W1>W3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���к�����ָ�������кͷ�Ӧ����lmol H2O���ų���������ijѧ����ͨ���ⶨ��Ӧ���������ų��������������к��ȡ�������50mL0.5mol/L��������50mL0.55mol/L��NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ����ش��������⣺

(1) ��ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��__________________���ձ���������������ĭ��������_________________________________��
(2) �������ỻ��ͬŨ�Ⱥ�ͬ����Ĵ��ᣬ����õ��к�����ֵ_________(����ƫ��������ƫС��������Ӱ����)
(3) ʵ���и���40 mL 0.50 mol/L�������50mL 0.55 mol/L��NaOH��Һ���з�Ӧ������
��ʵ����ȣ����ų�������_________(�������������� ������С�����������)��������_____________________________________________�������к��ȵ���ֵ��________(��������������������)��������_______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3(g)��5O2(g) ![]() 4NO(g)��6H2O(g)������������ȷ����(����)
4NO(g)��6H2O(g)������������ȷ����(����)
A. �ﵽ��ѧƽ��ʱ4v��(O2)��5v��(NO)
B. ����λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ�ﵽƽ��״̬
C. �ﵽ��ѧƽ��ʱ�������������ݻ���������Ӧ���ʼ�С���淴Ӧ��������
D. ��ѧ��Ӧ���ʹ�ϵ��2v��(NH3)��3v��(H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe3O4�к���Fe2+��Fe3+���ֱ��ʾΪ Fe(��)��Fe(��)����Fe3O4/PdΪ�����ϣ���ʵ���� H2�������Է�ˮ�е��°��� NO2-���䷴Ӧ����ʾ��ͼ��ͼ��ʾ������˵������ȷ����
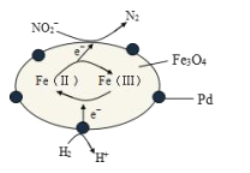
A.�ø÷�������ˮ��� pH����
B.Fe(��)�� Fe(��)���ת�����˴��ݵ��ӵ�����
C.��Ӧ������NO2-�� Fe(��)��ԭΪ N2
D.Pd �Ϸ����ĵ缫��ӦΪ��H2- 2e��== 2H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������;�dz��㷺���ش��������⣺
��1�����ķ���ϩ��Ʒ����Ϊ���ط�������������ճ��Ϳ�㡣����һ�����壬�þ�����һ����ƽ�����������ϸ�����λ����Ķ��ؾ��塣��ͨ��____�������־��塢����ͷǾ��塣
��2����̬�ࣨSb��ԭ�Ӽ۵����Ų��Ĺ��ʽΪ____��[H2F]+[SbF6]���������ࣩ��һ�ֳ�ǿ�ᣬ����[H2F]+�������ӵĿռ乹��Ϊ______������д��һ����[H2F]+������ͬ�ռ乹�ͺͼ�����ʽ�ķ��Ӻ������ӷֱ���_______��_________��
��3�����ᣨH3BO3�����ķ�����泥�NH4BF4����������Ҫ�Ļ�����;��
��H3BO3��NH4BF4�漰������Ԫ���еڶ�����Ԫ�صĵ�һ�������ɴ�С��˳��_____����Ԫ�ط��ţ���
��H3BO3�������ܵ����H+����ˮ�����һ��OH������[B(OH)4]���������������ԡ�[B(OH)4]����Bԭ�ӵ��ӻ�����Ϊ_____��
��NH4BF4���ķ�����泥�����������ͭ�������ۼ����ܸ�ʴ�����ȡ��ķ�������д���_______������ţ���
A ���Ӽ� B ���� C ���� D ��� E ���»���
��4��SF6���㷺������ѹ�����豸��Ե���ʡ�SF6��һ�ֹ��ۻ������ͨ��������Born-Haberѭ��������������ͼ����ͼa����������ϵ�ļ��ܡ���S��F�ļ���Ϊ_______kJ��mol-1��

��5��CuCl���۵�Ϊ426�棬�ۻ�ʱ���������磻CuF���۵�Ϊ908�棬�ܶ�Ϊ7.1g��cm-3��
��CuF��CuCl�۵�ߵ�ԭ����_____________��
�� ��֪NAΪ�����ӵ�������CuF�ľ����ṹ������ͼb������CuF�ľ�������a=__________nm ���г�����ʽ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com