
【题目】中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将①50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:

(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是_________________________________。
(2) 若将盐酸换成同浓度和同体积的醋酸,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”)
(3) 实验中改用40 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上
述实验相比,所放出的热量_________(填“比①大”、 “比①小”或“相等”),理由是_____________________________________________;所求中和热的数值会________(填“相等”或“不相等”),理由是_______________________________________________。
【答案】环形玻璃搅拌棒 保温、隔热,减少实验过程中的热量损失 偏小 比①小 因为酸、碱发生中和反应放出的热量与酸、碱的用量有关 相等 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量,它与酸、碱的用量无关
【解析】
(1)为了使酸碱充分反应,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒;为了减少实验误差,烧杯间填满塑料泡沫的作用是保温、隔热,减少实验过程中的热量损失。
(2)若将盐酸换成同浓度和同体积的醋酸,由于醋酸是弱酸,弱酸的电离吸收热量,反应放出的热量偏小,则求得的中和热数值偏小。
(3)实验中改用40 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,反应生成的水的物质的量小于①,所以实验所放出的热量比①小;而所求中和热的数值与①相等,因为中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量,它与酸、碱的用量无关。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】氮化镓( GaN)是制造SG芯片的材料,氮化铝LED灯可发出紫外光。回答下列问题:
(1) Ga的价电子排布式为____,该基态原子占据最高能级的电子云轮廓图形状为________。
下列状态的铝中,电离最外层的一个电子所需能量最小的是____(填字母)。
![]()
(2)8 -羟基喹啉铝常用于发光材料及电子传输材料,可由LiAlH4与 合成。LiAlH4中阴离子的空间构型为_____________,
合成。LiAlH4中阴离子的空间构型为_____________, 所含元素中电负性最大的是____(填元素符号),N的杂化方式为________________
所含元素中电负性最大的是____(填元素符号),N的杂化方式为________________
(3)金属晶体Al、Ga的熔点分别为660℃、30℃,Al比Ga熔点高的原因是____________
(4)氮化镓为六方晶胞,结构如右图所示。该晶体密度为ρg/cm3,晶胞参数a=b≠c(单位:pm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=____pm(用含a、ρ、NA的代数式表示)。

(5)在立方晶胞中,与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面。如右图,该立方晶胞中(1,1,1)晶面共有____个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为Zn-Cu原电池的示意图,请回答:

(1)锌片为原电池的_____极,铜片为原电池的____极(填“正”或“负”)
(2)锌电极反应式是_______,属于______反应(填“氧化”或“还原”);铜电极反应式是______,属于______反应(同上)。
(3)______(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中H+在______(填“锌片”或“铜片”)获得电子。
(4)若锌片减轻0.1mol,则另一极放出气体的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃,101kPa下,lg C8H18(辛烷)(相对分子质量:114)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是( )
A. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1
B. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国尿素合成塔(尿塔)使用寿命仅为欧美国家的1/4。为此北京钢铁研究院对某尿塔腐蚀过程进行研究,得出下列腐蚀机理:
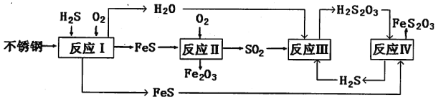
(1)H2S来自合成尿素的天然气。在380K、体积为2L的密闭容器中,存在反应:H2(g)+S(s)![]() H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
①380K时该反应的化学平衡常数为__________。
②下列对该反应分析正确的是_________(填序号)。
(2)反应II的化学方程式为:____________________________________。
(3)已知室温下H2S2O3:K1=2.2×10-1,K2=2.5×10-2。
①Na2S2O3水溶液中电荷守恒式为___________________________;
②反应IV的化学方程式_____________________________________。该反应_________(填“能”或“不能”)说明FeS溶解性强于FeS2O3。
(4)此尿塔的最终腐蚀产物为__________________。为了有效防腐,北钢建议该尿塔在生产中用CuSO4溶液“脱硫(H2S)”,离子反应方程式为_________。(室温下,H2S:K1=1.3×10-7、K2=7.1×10-15。CuS:Ksp=6.3×10-36)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有___离子,滤渣中含有___;在溶解过滤时使用的仪器有___。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式____。
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为____。
(5)计算该样品中铝的质量分数的表达式为___。
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果___(“偏高”“偏低”或“无影响”,下同)。若第(4)步对沉淀的灼烧不充分时,会使测定的结果___。若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下转化关系,E为淡黄色粉末,通常用在呼吸面具中作为氧气的来源。

(1)A、C、E、F的化学式:
A______,C______,E______,F______。
(2)向饱和的C的溶液中通入足量CO2,会出现的现象是_____,有关反应的化学方程式为____。
(3)鉴别C与F溶液应选用的试剂是_____,有关反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1的某二元酸H2A溶液中,可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
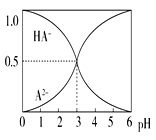
A. H2A的电离方程式:H2A![]() H++HA-
H++HA-
B. pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合, 离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+ 2c(H2A),各粒子浓度均大于0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)光束通过Fe(OH)3胶体,可看到光亮的通路,这种现象叫__________________
(2)19g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,求ACl2的摩尔质量________
(3)在标准状况下,测得4.2g气体A的体积是3360mL,则A可能是什么气体________
(4)在标准状况下15 g CO与CO2的混合气体,体积为11.2L。则:CO2和CO的体积之比是_____________
(5)在标准状况下,将224 L HCl气体溶于635 mL水(水的密度看作1g/mL)中,所得盐酸的密度为1.18 g·cm-3。所得盐酸物质的量浓度是___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com