
����Ŀ�������£�0.1 mol��L��1��ij��Ԫ��H2A��Һ�У����ܴ��ڵĺ�A����(H2A��HA����A2��)�����ʵ���������pH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����(����)
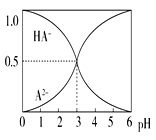
A. H2A�ĵ��뷽��ʽ��H2A![]() H����HA��
H����HA��
B. pH��5ʱ,��NaHA��Na2A�Ļ����Һ��:c(HA��):c(A2��)��1:100
C. �����ʵ���Ũ�ȵ�NaHA��Na2A��Һ�������ϣ� ����Ũ�ȴ�С��ϵΪ��c(Na��)>c(HA��)>c(A2��)
D. Na2A��Һ�ش���c(OH��)��c(H��)��c(HA��)�� 2c(H2A)��������Ũ�Ⱦ�����0
���𰸡�B
�����������������A����Ԫ��H2A��Һ�в���������ӣ�˵����һ����ȫ���룬��Ԫ��H2A�ĵ��뷽��ʽΪ��H2A=H++HA-��HA-H++A2-����A����B����ͼ�������pH=3ʱ��c(HA-)��c(A2-)��ͬ��pH=5ʱ��c(HA-)��c(A2-)=1��100����B��ȷ��C�������ʵ���Ũ�ȵ�NaHA��Na2A��Һ�������Ϻ����Ƚ�c(HA-)��c(A2-)�Ĵ�С����C����D����Ԫ��H2A�ĵ��뷽��ʽΪ��H2A=H++HA-��HA-H++A2-��Na2A��Һ�в�����H2A���ӣ�c(H2A)=0����D���ʴ�ΪB��


 һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ�ɷ�ΪAl2O3��������������)����ȡ���Ĺ������̼��������£�
�Իش��������⡣
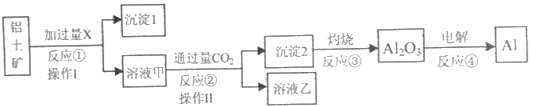
��1���Լ�XΪ___����Ӧ�ٵ����ӷ���ʽΪ___��
��2�������������Ϊ___(���������)����Ӧ�٢ڢۢ�������������ԭ��Ӧ����___(���������)��
��3����Ӧ�ڵ����ӷ���ʽΪ___��
��4�����������������Ļ�����ڸ����»ᷢ�����ҵķ�Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ___����5�����������������ȡ������������0.6mol���ӷ���ת�ƣ��������ܵõ���������������___g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���к�����ָ�������кͷ�Ӧ����lmol H2O���ų���������ijѧ����ͨ���ⶨ��Ӧ���������ų��������������к��ȡ�������50mL0.5mol/L��������50mL0.55mol/L��NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ����ش��������⣺

(1) ��ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��__________________���ձ���������������ĭ��������_________________________________��
(2) �������ỻ��ͬŨ�Ⱥ�ͬ����Ĵ��ᣬ����õ��к�����ֵ_________(����ƫ��������ƫС��������Ӱ����)
(3) ʵ���и���40 mL 0.50 mol/L�������50mL 0.55 mol/L��NaOH��Һ���з�Ӧ������
��ʵ����ȣ����ų�������_________(�������������� ������С�����������)��������_____________________________________________�������к��ȵ���ֵ��________(��������������������)��������_______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Է�Ӧ��aA(g)+bB(g)![]() cC(g)+dD(g) ��H����Ӧ�ص����Ӧ��ͼ���˵���в���ȷ����
cC(g)+dD(g) ��H����Ӧ�ص����Ӧ��ͼ���˵���в���ȷ����
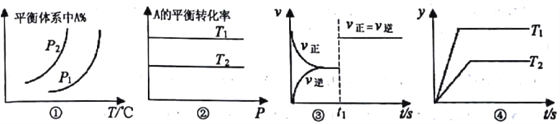
A. ͼ���У���P1>P2����÷�Ӧ�ڽϵ��¶����������Է�����
B. ͼ���У���T2>T1�����H<0 ��a+b=c+d
C. ͼ����t1ʱ�̸ı������һ����ʹ���˴���
D. ͼ���У�����H<0���������겻���ܱ�ʾ���Ƿ�Ӧ���ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe3O4�к���Fe2+��Fe3+���ֱ��ʾΪ Fe(��)��Fe(��)����Fe3O4/PdΪ�����ϣ���ʵ���� H2�������Է�ˮ�е��°��� NO2-���䷴Ӧ����ʾ��ͼ��ͼ��ʾ������˵������ȷ����
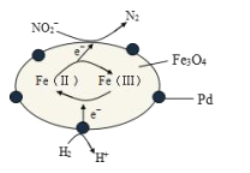
A.�ø÷�������ˮ��� pH����
B.Fe(��)�� Fe(��)���ת�����˴��ݵ��ӵ�����
C.��Ӧ������NO2-�� Fe(��)��ԭΪ N2
D.Pd �Ϸ����ĵ缫��ӦΪ��H2- 2e��== 2H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���W������������߷��Ӳ��Ϻϳɵ��м���ȣ��Ʊ�W��һ�ֺϳ�·�����¡�

��ش��������⣺
��1��F�Ļ�ѧ������________���ݵķ�Ӧ������________��
��2��E�к��еĹ�������________��д���ƣ���D�ۺ����ɸ߷��ӻ�����Ľṹ��ʽΪ________��
��3������Ӧ�۵õ��IJ�����O2�ڴ��������ȵ������·�Ӧ�ɵ�D��д����Ӧ�ܵĻ�ѧ����ʽ________��
��4���ܡ��������ܷ�ߵ���________��������������������������________��
��5����A���к�����ͬ�����ŵķ��㻯�����ͬ���칹�廹��________�֣����������칹�������к˴Ź�������Ϊ����壬�ҷ����֮��Ϊ1��1��2��2��2��2�Ľṹ��ʽΪ________��
��6�������л���W�������ϳ�·�ߣ���N������ʽΪC8H8������A��ͬϵ�Ϊԭ���Ʊ�  �ĺϳ�·�ߣ����Լ���ѡ��_________��
�ĺϳ�·�ߣ����Լ���ѡ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������CO2���������ӻ�Ӿ�����ЧӦ��Ϊ�������ŷţ��轫��ҵ�����в�����CO2����������д�������á�
(1)CO2��NH3��Ӧ�ɺϳɻ�������[��ѧʽΪCO(NH2)2]����Ӧ2NH3(g)��CO2(g)![]() CO(NH2)2(l)��H2O(g)�ںϳ����н��С���ͼ1�Т���������Ϊ�ϳ����а���ͬ��̼��[
CO(NH2)2(l)��H2O(g)�ںϳ����н��С���ͼ1�Т���������Ϊ�ϳ����а���ͬ��̼��[![]() ]��ˮ̼��[
]��ˮ̼��[![]() ]Ͷ��ʱ������̼ת���ʵ������
]Ͷ��ʱ������̼ת���ʵ������
�����ߢ�ˮ̼�ȵ���ֵ��Χ�ֱ�Ϊ0.6��0.7��1��1.1��1.5��1.61����������Ӧѡ��ˮ̼�ȵ���ֵ��ΧΪ____��
�����Ʋ������а�̼�ȿ�����4.0���һ��ǿ�����4.5���ұȽ����ˣ��������������_____��
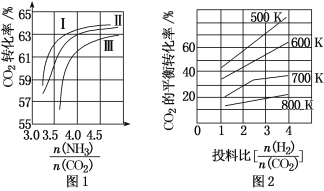
(2)CO2��H2Ҳ�����ںϳɼ״���CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��������ɱ�ĺ�ѹ�ܱ������У��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת������ͼ2��ʾ��
CH3OH(g)+H2O(g)��������ɱ�ĺ�ѹ�ܱ������У��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת������ͼ2��ʾ��
�ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽΪ_____��
�ڸ÷�Ӧ����S___0����H___0(����>������<��)��
��700KͶ�ϱ�[![]() ]=2ʱ��H2��ƽ��ת����Ϊ_____��
]=2ʱ��H2��ƽ��ת����Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.100mol��L1��NaOH��Һ�ֱ�ζ���Ϊ20.00mL0.100mol��L1��HCl��Һ�ʹ�����Һ���ζ�������ͼ��ʾ������˵����ȷ����
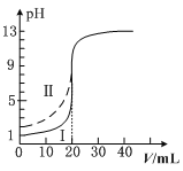
A.���ʾ���ǵζ����������
B.pH=7ʱ���ζ��������ĵ�V��NaOH����20.00mL
C.V��NaOH����20.00mLʱ��������Һ��c��Cl������c��CH3COO����
D.V��NaOH����10.00mLʱ��������c��Na+����c��CH3COO������c��H+����c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ��ʵ��,��x���ʾ���������ĵ��ӵ����ʵ���,��y��ɱ�ʾ( )
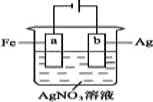

��c(Ag+) ��c(AgNO3) ��a�������� ��b�������� ����Һ��pH
A. �٢�B. �ۢ�C. �٢ڢ�D. �٢ڢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com