
【题目】从铝土矿(主要成分为Al2O3,还有少量杂质)中提取铝的工艺流程及步骤如下:
试回答下列问题。
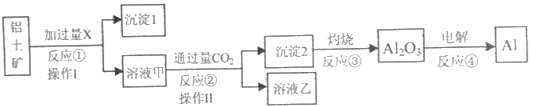
(1)试剂X为___;反应①的离子方程式为___。
(2)操作Ⅰ、操作Ⅱ均为___(填操作名称)。反应①②③④中属于氧化还原反应的是___(填数字序号)。
(3)反应②的离子方程式为___。
(4)金属铝与氧化铁的混合物在高温下会发生剧烈的反应,该反应的化学方程式为___。(5)电解熔融氧化铝制取金属铝,若有0.6mol电子发生转移,理论上能得到金属铝的质量是___g。
【答案】氢氧化钠溶液 Al2O3+2OH-=2AlO2-+H2O 过滤 ④ CO2+AlO2—+2H2O =Al(OH)3↓+HCO3— 2Al+Fe2O3![]() 2Fe+Al2O3 5.4
2Fe+Al2O3 5.4
【解析】
由电解Al2O3得到Al倒推知:滤液甲中含有铝元素,通入CO2生成氢氧化铝沉淀。说明加入试剂X为氢氧化钠,则生成滤液甲中含有偏铝酸钠,滤液乙NaHCO3
(1)滤液甲中含有铝元素,通入CO2生成氢氧化铝沉淀,说明甲中含有偏铝酸钠,加入试剂X为氢氧化钠溶液;反应①的离子方程式为:Al2O3+2OH-=2AlO2-+H2O
(2)操作Ⅰ、操作Ⅱ均为将固体与液体分离,操作为过滤;反应①②③均无价态变化,不属于氧化还原反应,④电解熔融氧化铝制取金属铝有化合价改变,属于氧化还原反应。
(3)CO2过量生成HCO3—不是CO32—,CO2+ AlO2— + 2H2O = Al(OH)3↓+ HCO3—
(4)金属铝与氧化铁的混合物在高温下会发生铝热反应:2Al+Fe2O3![]() 2Fe+Al2O3。
2Fe+Al2O3。
(5)分析电解熔融氧化铝制取金属铝电子转移的关系:![]()
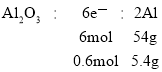
所以理论得到铝的质量为5.4g。


科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数的值,下列叙述正确的是
A.![]() 的
的![]() 溶液与等体积、等浓度的的
溶液与等体积、等浓度的的![]() 溶液混合后,溶液中
溶液混合后,溶液中![]() 的数目为1/3NA
的数目为1/3NA
B.4.6g乙醇分子中含有的碳氢键数目为0.5NA
C.2.1g DTO中含有的中子数为NA
D.常温常压下,0.5mol铁片和足量浓硫酸混合,转移电子数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镓( GaN)是制造SG芯片的材料,氮化铝LED灯可发出紫外光。回答下列问题:
(1) Ga的价电子排布式为____,该基态原子占据最高能级的电子云轮廓图形状为________。
下列状态的铝中,电离最外层的一个电子所需能量最小的是____(填字母)。
![]()
(2)8 -羟基喹啉铝常用于发光材料及电子传输材料,可由LiAlH4与 合成。LiAlH4中阴离子的空间构型为_____________,
合成。LiAlH4中阴离子的空间构型为_____________, 所含元素中电负性最大的是____(填元素符号),N的杂化方式为________________
所含元素中电负性最大的是____(填元素符号),N的杂化方式为________________
(3)金属晶体Al、Ga的熔点分别为660℃、30℃,Al比Ga熔点高的原因是____________
(4)氮化镓为六方晶胞,结构如右图所示。该晶体密度为ρg/cm3,晶胞参数a=b≠c(单位:pm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=____pm(用含a、ρ、NA的代数式表示)。

(5)在立方晶胞中,与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面。如右图,该立方晶胞中(1,1,1)晶面共有____个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应N2(g)+3H2(g)2NH3(g),在1L密闭容器中进行,5min内氨的物质的量增加了0.2mol,则反应速率为( )
A. v(H2)=0.015mol/(L·min)B. v(N2)=0.02mol/(L·min)
C. v(NH3)=0.17mol/(L·min)D. v(NH3)=0.01mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于NaHCO3和Na2CO3的性质判断正确的是( )
A.相同温度下的溶解度:NaHCO3>Na2CO3
B.常温下,相同物质的最浓度溶液的pH:NaHCO3<Na2CO3
C.热稳定性:NaHCO3<Na2CO3
D.等物质的量浓度的两种盐溶液与同浓度、同体积的盐酸反应生成气体的快慢:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。W的气态氢化物遇湿润的红色石蕊试纸变蓝色,X是地壳中含量最高的元素,Y在同周期主族元素中原子半径最大,Z与Y形成的化合物的化学式为YZ。下列说法不正确的是()
A.W在元素周期表中的位置是第二周期第VA族
B.同主族中Z的气态氢化物稳定性最强
C.X与Y形成的两种常见的化合物中,阳离子和阴离子的个数比均为2∶1
D.用电子式表示YZ的形成过程为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为Zn-Cu原电池的示意图,请回答:

(1)锌片为原电池的_____极,铜片为原电池的____极(填“正”或“负”)
(2)锌电极反应式是_______,属于______反应(填“氧化”或“还原”);铜电极反应式是______,属于______反应(同上)。
(3)______(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中H+在______(填“锌片”或“铜片”)获得电子。
(4)若锌片减轻0.1mol,则另一极放出气体的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃,101kPa下,lg C8H18(辛烷)(相对分子质量:114)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是( )
A. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1
B. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1的某二元酸H2A溶液中,可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
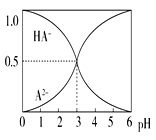
A. H2A的电离方程式:H2A![]() H++HA-
H++HA-
B. pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合, 离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+ 2c(H2A),各粒子浓度均大于0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com