
【题目】大气中CO2含量的增加会加剧温室效应,为减少其排放,需将工业生产中产生的CO2分离出来进行储存和利用。
(1)CO2与NH3反应可合成化肥尿素[化学式为CO(NH2)2],反应2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[
CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[![]() ]和水碳比[
]和水碳比[![]() ]投料时二氧化碳转化率的情况。
]投料时二氧化碳转化率的情况。
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值范围分别为0.6~0.7、1~1.1和1.5~1.61,则生产中应选用水碳比的数值范围为____。
②请推测生产中氨碳比控制在4.0左右还是控制在4.5左右比较适宜,并简述你的理由_____。
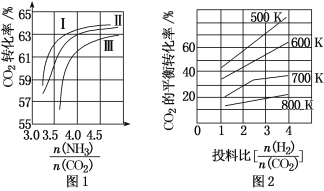
(2)CO2与H2也可用于合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。
CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。
①该反应的化学平衡常数的表达式为_____。
②该反应的ΔS___0,ΔH___0(填“>”或“<”)。
③700K投料比[![]() ]=2时,H2的平衡转化率为_____。
]=2时,H2的平衡转化率为_____。
【答案】0.6~0.7 4.0比较适宜;氨碳比在4.5时,NH3的量增大较多,而CO2转化率增加不大,提高了生产成本 K=![]() < < 45%
< < 45%
【解析】
(1)①依据反应转化率的大小分析,结合图象分析判断;
②氨碳比在4.5时氨气量增大对二氧化碳的转化率增加不大;
(2)①根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行书写;
②根据反应前后气体的物质的量大小判断△S,根据温度对平衡的影响分析△H;
③由图可知,在700K,投料比[n(H2):n(CO2)]=2时,二氧化碳转化率为 30%,假设CO2、H2的起始物质的量分别为1mol、2mol,转化的二氧化碳为 0.3mol,根据方程式可知转化的氢气为0.9mol,进而计算H2的转化率。
(1)①氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为0.6~0.7;
②氨碳比在4.5时,需要氨气较多,但依据图象分析二氧化碳转化率增大不多,工业 合成氨生成工艺较复杂,提高生产成本,所以氨碳比应该控制在4.0左右;
(2)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以平衡常数K=![]() ;
;
②因为该反应为气体减小的反应,则△S<0,因为温度越高,CO2转化率越小,说明升高温度,平衡向逆反应方向移动,逆反应为吸热反应,则该反应正方向为放热反应,即△H<0;
③由图可知,在700K,投料比[n(H2):n(CO2)]=2时,二氧化碳转化率为 30%,假设CO2、H2的起始物质的量分别为1mol、2mol,转化的二氧化碳为 0.3mol,根据方程式可知转化的氢气为0.9mol,进而计算H2的转化率= 0.9mol 2mol ×100%=45%。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】如图为Zn-Cu原电池的示意图,请回答:

(1)锌片为原电池的_____极,铜片为原电池的____极(填“正”或“负”)
(2)锌电极反应式是_______,属于______反应(填“氧化”或“还原”);铜电极反应式是______,属于______反应(同上)。
(3)______(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中H+在______(填“锌片”或“铜片”)获得电子。
(4)若锌片减轻0.1mol,则另一极放出气体的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下转化关系,E为淡黄色粉末,通常用在呼吸面具中作为氧气的来源。

(1)A、C、E、F的化学式:
A______,C______,E______,F______。
(2)向饱和的C的溶液中通入足量CO2,会出现的现象是_____,有关反应的化学方程式为____。
(3)鉴别C与F溶液应选用的试剂是_____,有关反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1的某二元酸H2A溶液中,可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
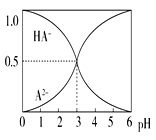
A. H2A的电离方程式:H2A![]() H++HA-
H++HA-
B. pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合, 离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+ 2c(H2A),各粒子浓度均大于0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。请回答下列问题:
(1)移取10.00 mL密度为ρg·mL-1的过氧化氢溶液至250mL______(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,请写出其反应的离子方程式_______。
(3)滴定时,将高锰酸钾标准溶液注入_______(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是________。
(4)重复滴定三次,平均耗用c mol·L-1KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为_________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_______(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把13g Zn放入足量的盐酸中,Zn完全反应。计算:
(1)13g Zn的物质的量___________
(2)参加反应的HCl的物质的量___________
(3)生成H2的体积(标准状况)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)+3B(g)![]() 2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
A.v(A)=0.01 mol/(Ls) B.v(C)=1.0mol/(Lmin)
C.v(B)=0.60mol/(Lmin) D.v(B)=0.04 mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)光束通过Fe(OH)3胶体,可看到光亮的通路,这种现象叫__________________
(2)19g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,求ACl2的摩尔质量________
(3)在标准状况下,测得4.2g气体A的体积是3360mL,则A可能是什么气体________
(4)在标准状况下15 g CO与CO2的混合气体,体积为11.2L。则:CO2和CO的体积之比是_____________
(5)在标准状况下,将224 L HCl气体溶于635 mL水(水的密度看作1g/mL)中,所得盐酸的密度为1.18 g·cm-3。所得盐酸物质的量浓度是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系________(填“属于”或“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/ mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为________(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=________mol·L-1。
(3)为减少SO2的排放,可用某些溶液洗涤含SO2的烟气。以下物质可做洗涤剂的是__________________________(填字母)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(4)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO的化学方程式:_____________________________。
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com