
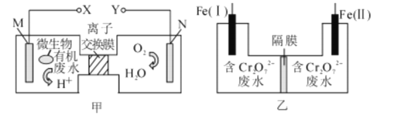
【题目】甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能;乙图是含Cr2O72-酸性废水的处理装置。将甲、乙两装置连接[Fe(Ⅱ)极与X极连接],可将Cr2O72-转化成Cr(OH)3沉淀而除去。下列说法错误的是
A.若废水中含有乙醛,则M极的电极反应为:CH3CHO+2H2O-8e-=2CO2↑+8H+,
B.电解一段时间后,在Fe(I)极附近有沉淀析出
C.装置乙的隔膜是阳离子交换膜
D.电路中每转移3 mol电子,最多有0.5 mol Cr2O72-被还原
【答案】CD
【解析】
甲装置为原电池装置,根据装置图以及原电池工作原理,M极为负极,N极为正极,Fe(II)与X电极相连,则Fe(II)为阴极,Fe(I)为阳极,即乙装置为电解池,然后利用原电池工作原理和电解池工作原理进行分析;
A. 甲装置是利用一种微生物将有机废水的化学能直接转化为电能,即甲装置为原电池,根据原电池工作原理,M极为负极,若废水中含有乙醛,则其电极反应式为CH3CHO+2H2O-8e-=2CO2↑+8H+,故A正确;
B. Fe(I)连接Y,即Fe(I)为阳极,电极反应式为Fe-2e-=Fe2+,该区域发生氧化还原反应6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,Fe(II)电极为阴极,电极反应式为2H++2e-=H2↑,H+不断在阴极上得电子成为H2而析出,且Cr2O72-与Fe2+的反应也在消耗H+,使得溶液酸性变为中性,再由中性变为碱性,Cr3++3OH-=Cr(OH)3↓,Fe3++3OH-=Fe(OH)3↓,因隔膜为离子交换膜,因此Fe(I)附近有沉淀产生,故B正确;
C. 根据乙装置以及B选项分析,乙装置右侧中Cr2O72-向左侧移动,则隔膜为阴离子交换膜,故C错误;
D. 根据B选项分析,建立12e-~6Fe2+~Cr2O72-,每转移3mol电子,最多有![]() =
=![]() molCr2O72-被还原,故D错误;
molCr2O72-被还原,故D错误;
答案:CD。


科目:高中化学 来源: 题型:
【题目】金属铋在自然界中的量极少,用途非常广泛,通常以辉铋矿为原料提取金属铋,工艺流程如图所示:

已知:①辉铋矿主要成分是Bi2S3,还含少量Bi2O3、SiO2、铁的氧化物和硫化物等。
②Bi2O3能溶于酸,NaBiO3不溶于水。
③常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Bi (OH)3]=4×10-30;Ksp[Fe(OH)2]=8.0×10-16;
回答下列问题:
(1)写出酸浸氧化时Bi2S3被氧化成硫单质的化学方程式_______________。
(2)滤渣1的成分为_______________。
(3)除杂剂的作用a.调节溶液pH,b_______________,写出一种能提高产物产量的除杂剂_______________。
(4)滤液2还可用来制备NaBiO3,可向滤液2中加入NaOH和NaClO溶液制取NaBiO3,写出该反应的离子方程式_______________。
(5)滤液2采用电解法制取金属铋单质,阳极产物处理后可继续循环使用,电解装置如图所示。

①交换膜类型为_______________(填“Cl-”或“OH-”)交换膜。
②阳极电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三元电池成为我国电动汽车的新能源,其电极材料可表示为![]() ,且
,且![]() 。充电时电池总反应为:
。充电时电池总反应为:![]() ,其电池工作原理如图,两极之间有一个允许特定离子X通过的隔膜。下列说法正确的
,其电池工作原理如图,两极之间有一个允许特定离子X通过的隔膜。下列说法正确的

A.充电时,A为阴极,![]() 被氧化
被氧化
B.允许离子X通过的隔膜属于阴离子交换膜
C.可从无法充电的废旧电池的石墨电极中回收大量金属锂
D.放电时,正极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,下列有机物分子中带“*”碳原子就是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中仍含有手性碳原子的是

A. 与银氨溶液作用发生银镜反应B. 催化剂作用下与![]() 反应
反应
C. 与乙酸发生酯化反应D. 与NaOH溶液加热条件下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应4NH3+5O2=4NO+6H2O,回答下列问题:
(1)该反应中氧化剂是_______________,被氧化的是_________元素。
(2)该反应中氧化剂与还原剂的物质的量之比为______________。
(3)若反应中转移了10mol电子,则生成的NO在标准状况下的体积为_________。
(4)用单线桥法标出电子转移的方向与数目 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镓( GaN)是制造SG芯片的材料,氮化铝LED灯可发出紫外光。回答下列问题:
(1) Ga的价电子排布式为____,该基态原子占据最高能级的电子云轮廓图形状为________。
下列状态的铝中,电离最外层的一个电子所需能量最小的是____(填字母)。
![]()
(2)8 -羟基喹啉铝常用于发光材料及电子传输材料,可由LiAlH4与 合成。LiAlH4中阴离子的空间构型为_____________,
合成。LiAlH4中阴离子的空间构型为_____________, 所含元素中电负性最大的是____(填元素符号),N的杂化方式为________________
所含元素中电负性最大的是____(填元素符号),N的杂化方式为________________
(3)金属晶体Al、Ga的熔点分别为660℃、30℃,Al比Ga熔点高的原因是____________
(4)氮化镓为六方晶胞,结构如右图所示。该晶体密度为ρg/cm3,晶胞参数a=b≠c(单位:pm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=____pm(用含a、ρ、NA的代数式表示)。

(5)在立方晶胞中,与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面。如右图,该立方晶胞中(1,1,1)晶面共有____个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含![]()
![]() 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于NaHCO3和Na2CO3的性质判断正确的是( )
A.相同温度下的溶解度:NaHCO3>Na2CO3
B.常温下,相同物质的最浓度溶液的pH:NaHCO3<Na2CO3
C.热稳定性:NaHCO3<Na2CO3
D.等物质的量浓度的两种盐溶液与同浓度、同体积的盐酸反应生成气体的快慢:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国尿素合成塔(尿塔)使用寿命仅为欧美国家的1/4。为此北京钢铁研究院对某尿塔腐蚀过程进行研究,得出下列腐蚀机理:
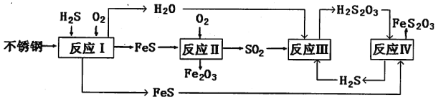
(1)H2S来自合成尿素的天然气。在380K、体积为2L的密闭容器中,存在反应:H2(g)+S(s)![]() H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
①380K时该反应的化学平衡常数为__________。
②下列对该反应分析正确的是_________(填序号)。
(2)反应II的化学方程式为:____________________________________。
(3)已知室温下H2S2O3:K1=2.2×10-1,K2=2.5×10-2。
①Na2S2O3水溶液中电荷守恒式为___________________________;
②反应IV的化学方程式_____________________________________。该反应_________(填“能”或“不能”)说明FeS溶解性强于FeS2O3。
(4)此尿塔的最终腐蚀产物为__________________。为了有效防腐,北钢建议该尿塔在生产中用CuSO4溶液“脱硫(H2S)”,离子反应方程式为_________。(室温下,H2S:K1=1.3×10-7、K2=7.1×10-15。CuS:Ksp=6.3×10-36)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com