
【题目】已知镁能分别与O2、N2、CO2反应,反应的化学方程式分别是 2Mg+O2![]() 2MgO、3Mg+N2
2MgO、3Mg+N2![]() Mg3N2、2Mg+CO2
Mg3N2、2Mg+CO2![]() 2MgO+C。把等质量的金属镁分别放在:①足量纯氧气中;②足量二氧化碳气体中;③足量空气中,完全燃烧后,得到的固体物质的质量分别对应的是W1g、W2g和W3g。以下三者的关系正确的是( )
2MgO+C。把等质量的金属镁分别放在:①足量纯氧气中;②足量二氧化碳气体中;③足量空气中,完全燃烧后,得到的固体物质的质量分别对应的是W1g、W2g和W3g。以下三者的关系正确的是( )
A.W1>W2>W3B.W3=W1>W2C.W3>W2>W1D.W2>W1>W3
科目:高中化学 来源: 题型:
【题目】根据反应4NH3+5O2=4NO+6H2O,回答下列问题:
(1)该反应中氧化剂是_______________,被氧化的是_________元素。
(2)该反应中氧化剂与还原剂的物质的量之比为______________。
(3)若反应中转移了10mol电子,则生成的NO在标准状况下的体积为_________。
(4)用单线桥法标出电子转移的方向与数目 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了如下图所示的实验装置。

已知:
①氯气和碱反应放出热量。
②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
请回答下列问题。
(1)甲装置中仪器a的名称是___。
(2)圆底烧瓶内发生反应的化学方程式为___;装置乙中饱和食盐水的作用是___。
(3)装置丁中发生反应的离子方程式为___。
(4)漂白粉在空气中失效的原因是___、___(用化学方程式表示)。
(5)①该小组制得的漂白粉中n(CaCl2)远大于n[Ca(C1O)2],其主要原因是___。
②为提高Ca(ClO)2的含量,可采取的措施是___(任写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①---⑩号元素在周期表中的位置如图。试回答下列问题:
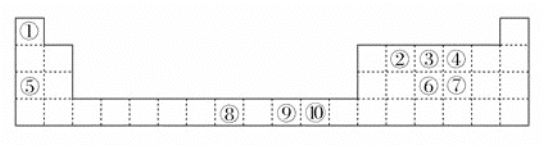
(1)上述元素中属于d区的有:________。
(2)②、③、④三种元素的第一电离能由大到小的顺序为_________(用元素符号表示)。
(3)⑧号元素在元素周期表中的位置是_______________,其原子核外未成对电子数为_______________,⑩号原子处于基态时核外电子排布式为___________,已知元素⑩和⑦的电负性分别为1.9和2.5,则⑩与⑦形成的化合物属于__________(填“离子”或“共价”)化合物。
(4)③号元素原子与①号元素原子形成的原子个数比为![]() 的分子X在①与④形成的化合物Y中的溶解度很大,其主要原因是____________。
的分子X在①与④形成的化合物Y中的溶解度很大,其主要原因是____________。
(5)④号和⑦号元素组成的原子个数比为3:1的-2价阴离子的空间构型、中心原子的杂化类型分别是:____________,____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。
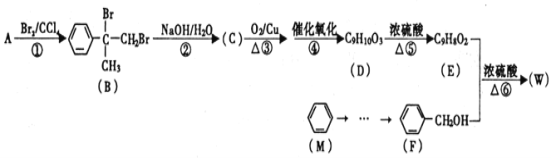
请回答下列问题:
(1)F的化学名称是________,⑤的反应类型是________。
(2)E中含有的官能团是________(写名称),D聚合生成高分子化合物的结构简式为________。
(3)将反应③得到的产物与O2在催化剂、加热的条件下反应可得D,写出反应④的化学方程式________。
(4)④、⑤两步能否颠倒?________(填“能”或“否”)理由是________。
(5)与A具有含有相同官能团的芳香化合物的同分异构体还有________种(不含立体异构),其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为________。
(6)参照有机物W的上述合成路线,以N(分子式为C8H8且属于A的同系物)为原料制备 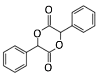 的合成路线(无机试剂任选)_________。
的合成路线(无机试剂任选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国尿素合成塔(尿塔)使用寿命仅为欧美国家的1/4。为此北京钢铁研究院对某尿塔腐蚀过程进行研究,得出下列腐蚀机理:
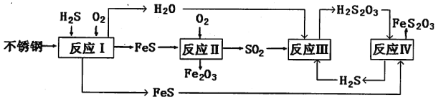
(1)H2S来自合成尿素的天然气。在380K、体积为2L的密闭容器中,存在反应:H2(g)+S(s)![]() H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
①380K时该反应的化学平衡常数为__________。
②下列对该反应分析正确的是_________(填序号)。
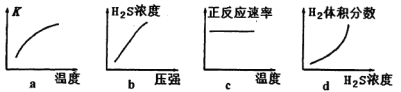
(2)反应II的化学方程式为:____________________________________。
(3)已知室温下H2S2O3:K1=2.2×10-1,K2=2.5×10-2。
①Na2S2O3水溶液中电荷守恒式为___________________________;
②反应IV的化学方程式_____________________________________。该反应_________(填“能”或“不能”)说明FeS溶解性强于FeS2O3。
(4)此尿塔的最终腐蚀产物为__________________。为了有效防腐,北钢建议该尿塔在生产中用CuSO4溶液“脱硫(H2S)”,离子反应方程式为_________。(室温下,H2S:K1=1.3×10-7、K2=7.1×10-15。CuS:Ksp=6.3×10-36)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO2(g) + O2(g) ![]() 2SO3(g) ΔH = a kJ/mol,能量变化如图所示。下列说法中,不正确的是( )
2SO3(g) ΔH = a kJ/mol,能量变化如图所示。下列说法中,不正确的是( )
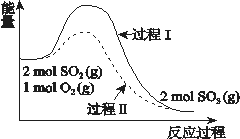
A. 2SO2(g) + O2(g) ![]() 2SO3(l) ΔH > a kJ/mol
2SO3(l) ΔH > a kJ/mol
B. 过程II可能使用了催化剂,使用催化剂不可以提高SO2的平衡转化率
C. 反应物断键吸收能量之和小于生成物成键释放能量之和
D. 将2molSO2(g) 和1mol O2(g)置于一密闭容器中充分反应后放出或吸收的热量小于┃a┃ kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中,下列电离方程式正确的是( )
A.CaCl2===Ca2++Cl2B.Na2SO4=== Na++![]()
C.HNO3=== H++![]() D.NaHCO3===Na++H++
D.NaHCO3===Na++H++![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一个体积可变的密闭容器中充入2 mol的气体A和1 mol的气体B发生反应:2A(g)+B(g)![]() 3C(g) ΔH>0。t1时刻反应达到平衡,并测得C在容器中的体积分数为φ1。t2时刻改变某一条件(其他条件不变),C在容器中的体积分数的变化如图所示,则t2时刻改变的条件是( )
3C(g) ΔH>0。t1时刻反应达到平衡,并测得C在容器中的体积分数为φ1。t2时刻改变某一条件(其他条件不变),C在容器中的体积分数的变化如图所示,则t2时刻改变的条件是( )

A. 加入1 mol氦气
B. 加入1 mol B
C. 增大压强
D. 升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com