
| 元素 | 相关信息 |
| X | X最外层电子数是次外层电子数的2倍 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的非金属性大于Y |
| W | W的一种核素的质量数为23,中子数为12 |
| 1 |
| 2 |
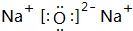 ,
,
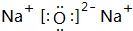 ;
; ;
;| 3.36L |
| 22.4L/mol |
| 1 |
| 3 |
| 1 |
| 2 |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 制取及观察Fe(OH)2 |
B、 比较两种物质的稳定性 |
C、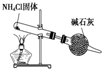 实验室制取NH3 |
D、 分离沸点不同且互溶的液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、230Th和232Th是钍的两种同素异形体 |
| B、H2与T2互为同位素 |
| C、甲醇与乙二醇互为同系物 |
| D、乙酸乙酯与丁酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaAlO2溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- |
| B、碘水中通入适量的SO2:I2+SO2+2H2O═2HI+SO42-+2H+ |
| C、FeSO4溶液中滴加双氧水:2Fe2++2H2O2═2Fe3++O2↑+2H2O |
| D、Na2CO3发生水解反应:CO32-+2H2O═H2CO3+2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com