
| n |
| V |
| 1.6mol |
| 2L |
| ||
| 2min |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
| A、银氨溶液、溴水 |
| B、酸性高锰酸钾溶液、氯化铁溶液 |
| C、酸性高锰酸钾溶液、溴水 |
| D、氯化铁溶液、溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 物质 | 杂质 | 试剂 | 操作方法 |
| 1 | 乙烷 | 乙烯 | ||
| 2 | 溴苯 | 溴 | ||
| 3 | 苯 | 甲苯 | ||
| 4 | 苯 | 苯酚 | ||
| 5 | 乙醇 | 水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
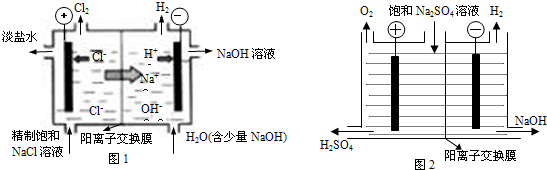
查看答案和解析>>
科目:高中化学 来源: 题型:
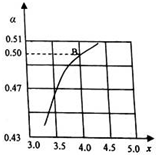 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种.请回答下列问题:| n(NH3) |
| n(CO2) |
| 两性氢氧化物 | Al(OH)3 | Ga(OH)3 |
| 酸式电离常数Kia | 2 10-11 | 1×10-7 |
| 碱式电离常数Kib | 1.3 10-33 | 1.4 10-34 |
查看答案和解析>>
科目:高中化学 来源: 题型:
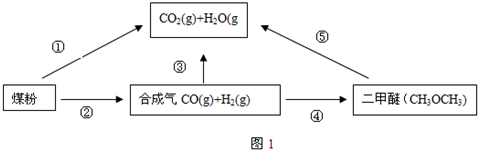
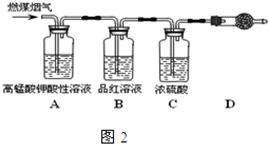
 (4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
(4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则: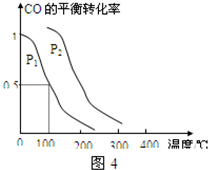
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 高温高压 |
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 浓度/mol?L-1 时间/min |
c(CO) | c(H2) | c(CH3OH) |
| 0 | 1.0 | 2.0 | 0 |
| 2 | 0.8 | 0.2 | |
| 4 | 1.0 | 0.5 | |
| 6 | 1.0 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X最外层电子数是次外层电子数的2倍 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的非金属性大于Y |
| W | W的一种核素的质量数为23,中子数为12 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
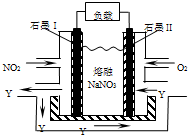 NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,该电池在使用过程中石墨I电极上生成氧化物Y,下列说法不正确的是( )
NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,该电池在使用过程中石墨I电极上生成氧化物Y,下列说法不正确的是( )| A、石墨I附近发生的反应为NO2+NO3--e-═N2O5 |
| B、石墨Ⅱ附近反生的反应为O2-4e-═2O2- |
| C、该电池放电时NO3-从右侧向左侧迁移 |
| D、相同条件下,放电过程中消耗的NO2和O2的体积比为4:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com