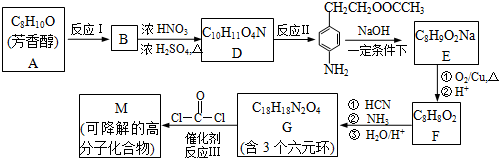
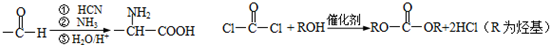过度排放CO
2 会造成“温室效应”,为了减少煤燃烧对环境赞成的污染,煤的气化是高效、清洁利用煤炭的重要途径.煤综合利用的一种途径如图1所示.
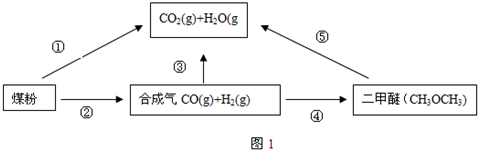
(1)用如图2所示装置客定量检测过程①产生的CO
2(提示:煤粉燃烧过程中也会产生SO
2;不考虑空
气中的CO
2和水蒸气对检测的影响)B中预期的现象是
,D中的试剂是
.
(2)已知C(s)+H
2O(g)═CO(g)+H
2(g)△H
1=+131.3kJ/mol
C(s)+2H
2O(g)═CO(g)+2H
2(g)△H
2=+90kJ?mol
-1则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是
(3)用图3装置可以完成过程⑤的转化.同时提高能量的利用率,a电极的电极反应式是

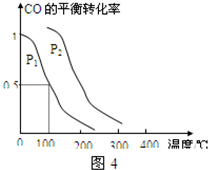
(4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H
2在催化剂作用下反应生成甲醇CO(g)+2H
2(g)═CH
3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
①P
1
P
2(填“>”、“<”、或“=”).
②在其它条件不变的情况下,向容器中增加a mol CO与2a mol H
2,达到新平衡时,CO的转化率
(填“增大”、“减小”或“不变”,下同),平衡常数
.
③在P
1下,100℃时,CH
3OH(g)═CO(g)+2H
2(g)反应的平衡常数为
(用含a、V的代数式表示)
(5)图4表示CO
2与H
2反应生成CH
3OH和H
2O的过程能量(单位为kJ?mol
-1)的变化:关于该反应的下列说法中,正确的是
(填序号)
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0.



 (4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
(4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:


 阅读快车系列答案
阅读快车系列答案