
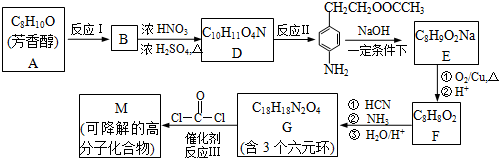
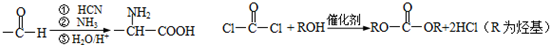
 ,氧化E中的醇羟基时,不能先酸化,否则酚羟基会被氧化,E经氧化酸化得F为
,氧化E中的醇羟基时,不能先酸化,否则酚羟基会被氧化,E经氧化酸化得F为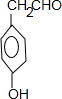 ;G含3个六元环,除两个苯环外应该有两个肽键成环G为
;G含3个六元环,除两个苯环外应该有两个肽键成环G为 ,据G和已知反应可推出M.
,据G和已知反应可推出M. ,E经氧化酸化得F为
,E经氧化酸化得F为 故答案为:
故答案为:

 ,据已知反应,可推出反应方程式为:
,据已知反应,可推出反应方程式为:


科目:高中化学 来源: 题型:
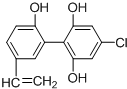 在2010年温哥华冬季奥运会上,有个别运动员因服用兴奋剂被取消参赛的资格.如图是检测出兴奋剂的某种同系物X的结构,关于X的说法正确的是( )
在2010年温哥华冬季奥运会上,有个别运动员因服用兴奋剂被取消参赛的资格.如图是检测出兴奋剂的某种同系物X的结构,关于X的说法正确的是( )| A、X分子中不可能所有原子都在同一平面上 |
| B、X遇到FeCl3溶液时显紫色,而且能使溴的四氯化碳溶液褪色 |
| C、1mol X与足量的浓溴水反应,最多消耗5mol Br2 |
| D、1mol X在一定条件下与足量的氢气反应,最多消耗1mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
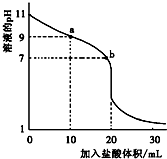 室温下,将0.1000mol?L-1盐酸滴入20.00mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )
室温下,将0.1000mol?L-1盐酸滴入20.00mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )| A、b点:c(M+)+c(MOH)=c(Cl-) |
| B、a到b点的水溶液导电性依次增强 |
| C、该一元碱溶液浓度为0.100 0 mol?L-1 |
| D、室温下,MOH的电离常数Kb=1×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸钡不溶于水,碳酸钡能溶于水 |
| B、硫酸钡是强酸盐,碳酸钡是弱酸盐 |
| C、硫酸钡不溶于水不溶于酸,碳酸钡不溶于水也不溶于酸 |
| D、硫酸钡不溶于水不溶于酸,碳酸钡不溶于水但能溶于酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 物质 | 杂质 | 试剂 | 操作方法 |
| 1 | 乙烷 | 乙烯 | ||
| 2 | 溴苯 | 溴 | ||
| 3 | 苯 | 甲苯 | ||
| 4 | 苯 | 苯酚 | ||
| 5 | 乙醇 | 水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
(4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则: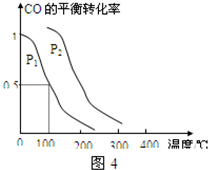
查看答案和解析>>
科目:高中化学 来源: 题型:
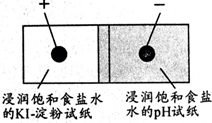 如图是利用试纸、铅笔芯设计的微型实验.以铅笔芯为电极,分别接触表面皿上的试纸,接通电源,观察实验现象.下列说法错误的是( )
如图是利用试纸、铅笔芯设计的微型实验.以铅笔芯为电极,分别接触表面皿上的试纸,接通电源,观察实验现象.下列说法错误的是( )| A、pH试纸变蓝 |
| B、KI-淀粉试纸变蓝 |
| C、通电时,电能转换为化学能 |
| D、电子通过pH试纸到达KI-淀粉试纸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com