
科目:高中化学 来源: 题型:
| A、氨水与亚硫酸溶液混合:NH3?H2O+H+═NH4++H2O | ||||
| B、SO2通入漂白粉溶液中:Ca(ClO)2+SO2+H2O═CaSO3↓+2HClO | ||||
C、铜与浓硫酸共热:Cu+4H++SO42-
| ||||
| D、把H2S通入CuSO4溶液中:H2S+Cu2+═CuS↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
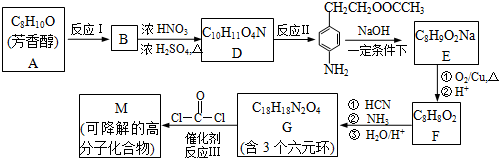
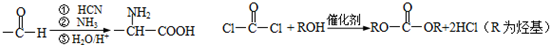
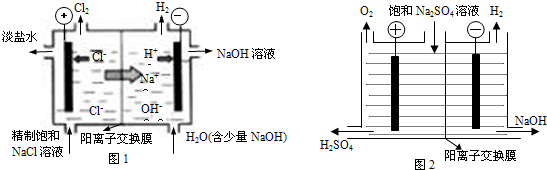
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、230Th和232Th是钍的两种同素异形体 |
| B、H2与T2互为同位素 |
| C、甲醇与乙二醇互为同系物 |
| D、乙酸乙酯与丁酸互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com