
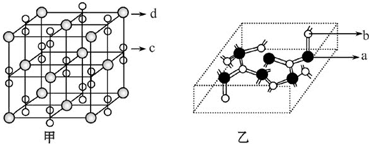
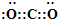 ,基态Cu原子核外电子排布式为:1s22s22p63s23p63d104s1,外围电子排布式为3d104s1,
,基态Cu原子核外电子排布式为:1s22s22p63s23p63d104s1,外围电子排布式为3d104s1,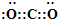 ; 3d104s1;
; 3d104s1;| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 3 |


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
| A、石墨比金刚石稳定 |
| B、金刚石与石墨中的化学性质相似 |
| C、1mol金刚石比1mol石墨的总能量高 |
| D、1mol石墨和金刚石完全燃烧时释放的能量石墨比金刚石多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到化学平衡时,υ正=υ逆=0 |
| B、若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C、达到化学平衡时,若增大容器体积,则正反应速率减少,逆反应速率增大 |
| D、达到化学反应平衡后,改变条件当υ正>υ逆,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
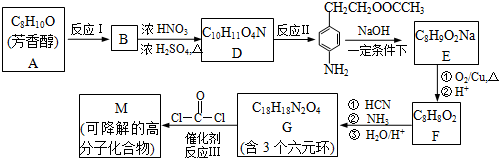
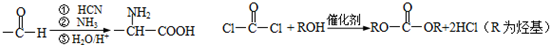
查看答案和解析>>
科目:高中化学 来源: 题型:
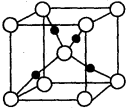 已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.
已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
226 88 |
| A、Ra元素位于元素周期表中第六周期ⅡA |
| B、RaSO4难溶于水和强酸 |
| C、RaCO3不能与盐酸反应 |
| D、Ra(OH)2是一种两性氢氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com