
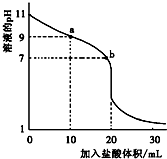
 室温下,将0.1000mol?L-1盐酸滴入20.00mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )
室温下,将0.1000mol?L-1盐酸滴入20.00mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )| A、b点:c(M+)+c(MOH)=c(Cl-) |
| B、a到b点的水溶液导电性依次增强 |
| C、该一元碱溶液浓度为0.100 0 mol?L-1 |
| D、室温下,MOH的电离常数Kb=1×10-5 |
| c(M+)c(OH-) |
| c(MOH) |
| c(M+)c(OH-) |
| c(MOH) |
| (0.0001)2 |
| 0.1000 |


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
| A、先加稀盐酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| B、先加稀硝酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| C、直接向溶液中滴加稀硝酸酸化过的氯化钡溶液,看是否生成白色沉淀 |
| D、直接向溶液中滴加稀盐酸酸化过的氯化钡溶液,看是否生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水与亚硫酸溶液混合:NH3?H2O+H+═NH4++H2O | ||||
| B、SO2通入漂白粉溶液中:Ca(ClO)2+SO2+H2O═CaSO3↓+2HClO | ||||
C、铜与浓硫酸共热:Cu+4H++SO42-
| ||||
| D、把H2S通入CuSO4溶液中:H2S+Cu2+═CuS↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可形成-l价离子 |
| B、从上到下原子半径逐渐减小 |
| C、从上到下原子半径逐渐增大 |
| D、从上到下非金属性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石墨比金刚石稳定 |
| B、金刚石与石墨中的化学性质相似 |
| C、1mol金刚石比1mol石墨的总能量高 |
| D、1mol石墨和金刚石完全燃烧时释放的能量石墨比金刚石多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
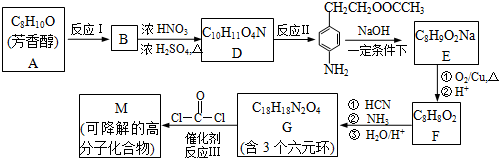
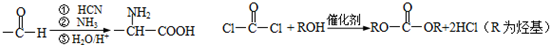
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com