
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.
![]() 实验目的
实验目的![]() 制取乙酸乙酯
制取乙酸乙酯
![]() 实验原理
实验原理![]() 甲、乙、丙三位同学均采取乙醇、乙酸与浓
甲、乙、丙三位同学均采取乙醇、乙酸与浓![]() 混合共热的方法制取乙酸乙酯,反应的方程式为 ______
混合共热的方法制取乙酸乙酯,反应的方程式为 ______ ![]() 其中浓
其中浓![]() 的作用是 ______ 和 ______
的作用是 ______ 和 ______
![]() 装置设计
装置设计![]() 甲、乙、丙三位同学分别设计如图三套实验装置:
甲、乙、丙三位同学分别设计如图三套实验装置:
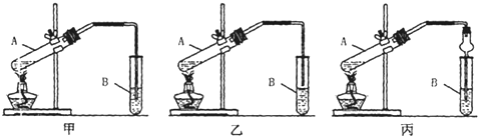
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是 ______ ![]() 选填“甲”或“乙”
选填“甲”或“乙”![]() ,丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是 ______
,丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是 ______
![]() 实验步骤
实验步骤![]()
![]() 按我选择的装置仪器,在试管中先加入3mL乙醇,并在摇动下缓缓加入2mL浓
按我选择的装置仪器,在试管中先加入3mL乙醇,并在摇动下缓缓加入2mL浓![]() 充分摇匀,冷却后再加入2mL冰醋酸;
充分摇匀,冷却后再加入2mL冰醋酸;![]() 将试管固定在铁架台上;
将试管固定在铁架台上;![]() 在试管B中加入适量的饱和
在试管B中加入适量的饱和![]() 溶液;
溶液;![]() 用酒精灯对试管A加热;
用酒精灯对试管A加热;![]() 当观察到试管B中有明显现象时停止实验.
当观察到试管B中有明显现象时停止实验.
![]() 问题讨论
问题讨论![]()
![]() 步骤
步骤![]() 装好实验装置,加入样品前还应检查 ______ .
装好实验装置,加入样品前还应检查 ______ .
![]() 从试管B中分离出乙酸乙酯的实验操作是 ______ .
从试管B中分离出乙酸乙酯的实验操作是 ______ .
【答案】![]()
![]()
![]() 催化剂 吸水剂 乙 防止倒吸 检查装置气密性 分液
催化剂 吸水剂 乙 防止倒吸 检查装置气密性 分液
【解析】
![]() 实验原理
实验原理![]() 酯化反应的本质为酸脱羟基,醇脱氢,乙醇、乙酸反应生成乙酸乙酯和水,且为可逆反应;乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
酯化反应的本质为酸脱羟基,醇脱氢,乙醇、乙酸反应生成乙酸乙酯和水,且为可逆反应;乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
![]() 装置设计
装置设计![]() 根据粗产品乙酸乙酯、乙酸和乙醇的混合物中各自的性质,以及加热不充分也能产生倒吸进行解答;
根据粗产品乙酸乙酯、乙酸和乙醇的混合物中各自的性质,以及加热不充分也能产生倒吸进行解答;
![]() 实验步骤
实验步骤![]() 实验前,要检查装置的气密性;
实验前,要检查装置的气密性;![]() 分离互不相溶的液体通常用分液的方法。
分离互不相溶的液体通常用分液的方法。
![]() 实验原理
实验原理![]() 酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:
酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:![]()
![]()
![]() ,乙酸与乙醇发生酯化反应,该反应为可逆反应,需浓硫酸作催化剂,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,故浓硫酸的作用为催化剂、吸水剂;
,乙酸与乙醇发生酯化反应,该反应为可逆反应,需浓硫酸作催化剂,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,故浓硫酸的作用为催化剂、吸水剂;
故答案为:![]()
![]()
![]() ;催化剂、吸水剂
;催化剂、吸水剂![]() 顺序可以颠倒
顺序可以颠倒![]() ;
;
![]() 装置设计
装置设计![]() 乙酸乙酯中混有乙醇和乙酸,二者易溶于水而产生倒吸,加热不充分也能产生倒吸,可用乙装置制取,防止倒吸回流现象的发生;丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,球形干燥管球形部分由于容积较大,也能起到防止倒吸的作用;
乙酸乙酯中混有乙醇和乙酸,二者易溶于水而产生倒吸,加热不充分也能产生倒吸,可用乙装置制取,防止倒吸回流现象的发生;丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,球形干燥管球形部分由于容积较大,也能起到防止倒吸的作用;
故答案为:乙;防止倒吸;
![]() 问题讨论
问题讨论![]() 实验前,要检查装置的气密性,否则会导致实验失败;
实验前,要检查装置的气密性,否则会导致实验失败;
故答案为:检查装置气密性;
![]() 因B
因B
故答案为:分液。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述中正确的是
A. 0.1 molKI与0.1 molFeC13在溶液中反应转移的电子数为0.1NA
B. 镁条在氮气中完全燃烧,生成50g氮化镁时,有1.5NA共用电子对被破坏
C. 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA
D. 标况时,22.4L二氯甲烷所含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2 ,下列说法不正确的是

A. 太阳能最终转变为化学能 B. T<1050℃时,CeO2-δ比CeO2稳定
C. CeO2是水分解的催化剂 D. 两步反应均属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应A(s)+3B(g)![]() 2C(g)+D(g)来说,下列反应速率最快的是( )
2C(g)+D(g)来说,下列反应速率最快的是( )
A. v(A)=0.02 mol/(Ls) B. v(B)=0.6 mol/(Lmin)
C. v(C)=0.5 mol/(Lmin) D. v(D)=0.01 mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:![]() (正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。下列叙述中正确的是
(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。下列叙述中正确的是
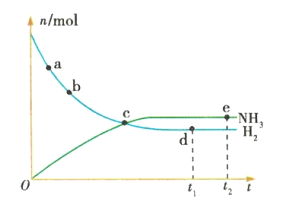
A.c点处正反应速率和逆反应速率相等
B.a点的正反应速率比b点的大
C.d点(t1时刻)和e点(t2时刻)处n(N2)不同
D.在t2时刻,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)决定化学反应速率的主要因素是参加反应的物质的________,影响化学反应速率的外因有_______________________(至少填2个);
(2)H2C2O4与KMnO4反应时,它转化为CO2和H2O。实验现象________________
(3)氢氧化钡晶体Ba(OH)2·8H2O与氯化铵反应方程式_________________。
(4)Na2S2O3与稀H2SO4反应离子方程式_______________________。
(5)将向含有KI和H2SO4的混合溶液中加入淀粉溶液,放置一段时间实验现象。________
(6)在H2O2溶液中加入少量MnO2实验现象____________
(7)当1 g氨气完全分解为氮气、氢气时,吸收2.72 kJ的热量,则热化学方程式_______________
(8)由金红石(TiO2)制取单质Ti,涉及的步骤为:TiO2→TiCl4+Mg→Ti。已知:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566 kJ/mol
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如下图转化关系,回答下列问题:
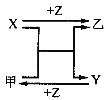
(1)若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子,Y原子的电子排布图为_________,乙的电子式为________;
(2)若X为非金属,甲是由两种短周期元素的原子构成的A2B型极性分子,且是常见的溶剂,甲的电子式___,乙的化学式为_____;
(3)若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应![]() 。采取下列措施能加快反应速率的是( )
。采取下列措施能加快反应速率的是( )
①升温 ②恒容下通入惰性气体 ③增加![]() 的浓度 ④减压 ⑤加催化剂 ⑥恒压下通入惰性气体
的浓度 ④减压 ⑤加催化剂 ⑥恒压下通入惰性气体
A.①②⑤B.①③⑤C.②④⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH
NH![]() +OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
+OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热⑥加入少量MgSO4固体
A.①②③⑤B.③⑥C.③D.③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com