
【题目】一定条件下,可逆反应C(s) + CO2(g) ![]() 2 CO(g) ΔH > 0,达到平衡状态,现进行如下操作:① 升高反应体系的温度;② 增加反应物C的用量;③ 缩小反应体系的体积;④ 减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的( )
2 CO(g) ΔH > 0,达到平衡状态,现进行如下操作:① 升高反应体系的温度;② 增加反应物C的用量;③ 缩小反应体系的体积;④ 减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的( )
A.①②③④ B.①③ C.④② D.①③④
【答案】B
【解析】
试题分析:①、其它条件不变时,升温,既能使正反应速率明显增大,也能使逆反应速率明显增大,但吸热方向的速率增大程度更大,①正确;②、单质碳是固体,增加固体的用量,不能加快反应速率,因为固体物质的浓度是一个常数(或不变量),②错误;③、其它条件不变时,缩小容积,既能增大反应物的浓度,又能增大生成物的浓度,因此正反应速率明显增大,逆反应速率也明显增大,但是其实质是增大压强,气体体积减小方向的速率增大程度更大,③正确;④、其它条件不变时,减小CO的量,就是减少生成物浓度,而此时反应物浓度不变,因此逆反应速率明显减小,而正反应速率先保持不变,然后因为平衡正向移动,导致正反应速率逐渐减小,直到达到新的平衡时保持不变,④错误;答案选B。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】钢铁在潮湿的空气中容易发生电化学腐蚀,其负极反应为
A. Fe-3e-=Fe3+
B. O2+2H2O+4e-=4OH-
C. 2H++2e-=H2↑
D. Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向1L pH=2的醋酸溶液中加入2L pH=2的盐酸,则混合溶液的pH为(假设混合后溶液体积不变,室温下醋酸的电离平衡常数为1.8×10-5)
A. 2.3 B. 1.7 C. 2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,会引起实验误差的是
A. 取干燥洁净的酸式滴定管即装入标准盐酸
B. 用蒸馏水冼净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定
C. 往盛有20.00mLNaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定
D. 用蒸馏水冼净锥形瓶后,再用NaOH液润洗,然后装入一定体积的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×10-amol·L-1和1.0×10-bmol·L-1,在此温度下,下列说法正确的是
A. a<b B. a=b
C. 水的离子积为1.0×10-(7+ a ) D. 水的离子积为1.0×10-(b+ a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验的微型化可有效减少污染,实现化学实验的绿色化。某同学按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。[已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O]
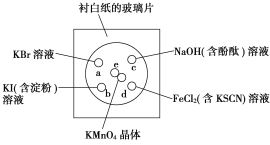
(1)e处发生反应的离子方程式为_______________________,该反应中氧化剂和还原剂的物质的量之比为_____________________。
(2)b处的实验现象为_______________________,
d处的实验现象为______________________。
(3)c处反应的化学方程式为_________________,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为________ mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?________(填“能”或“不能”),若能,其氧化性由强到弱的顺序是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列三种不同实验方案进行探究,请根据他们的设计回答有关问题。
【探究一】 实验方案:铝镁合金![]() 测定剩余固体质量。
测定剩余固体质量。
问题讨论:
(1)实验中发生反应的化学方程式是________________。
(2)若实验中称取5.4 g铝镁合金粉末样品,投入V mL
2.0 mol/L NaOH溶液中,充分反应。则NaOH溶液的体积V mL≥________mL。
(3)实验中,当铝镁合金充分反应后,在称量剩余固体质量前,还需进行的实验操作按顺序依次为________________。
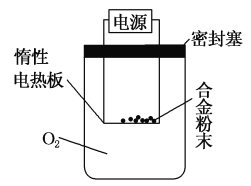
【探究二】实验方案:称量x g铝镁合金粉末,放在如图所示 装置的惰性电热板上,通电使其充分灼烧。
问题讨论:
(4)欲计算Mg的质量分数,该实验中还需测定的数据是____________。
(5)假设实验中测出该数据为y g,则原铝镁合金粉末中镁的质量分数为________(用含x、y的代数式表示)。
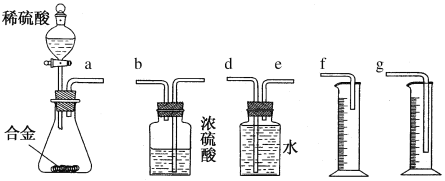
【探究三】 实验方案:铝镁合金![]() 测定生成气体的体积。
测定生成气体的体积。
问题讨论:
(6)同学们拟选用下边的实验装置完成实验,你认为最简易的装置的连接顺序是a接______________(填接口字母,仪器不一定全选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com