
某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K= 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
下列判断不正确的是
A.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
B.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
C.平衡时,乙中CO2的转化率大于60%
D.平衡时,甲中和丙中H2的转化率均是60%
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2016届安徽省高三上学期期中测试化学试卷(解析版) 题型:选择题
2015年8月12日晚,天津塘沽滨海新区危险品仓库发生大爆炸,造成了巨大损失。据悉,该危险品仓库存放的危险品有多种,包括剧毒化学品氰化钠(NaCN)。下列有关氰化钠的说法中错误的是
A.NaCN中碳元素的化合价为+4
B.NaCN易溶于水,其水溶液呈碱性
C.可用强氧化剂如H2O2等将NaCN氧化为无毒物质
D.为防止中毒,须加强对地表水、排海口等的氰化物排查
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省台州市高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列关于摩尔的说法中,正确的是
A.摩尔是表示物质质量的单位
B.摩尔是国际七个基本物理量之一
C.摩尔既是物质的量的单位,又是粒子的数量单位
D.用物质的量时,要指明粒子种类
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高一上学期期中测试化学试卷(解析版) 题型:选择题
在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中
A.氧化产物与还原产物的物质的量之比为5:2
B.氧化产物与还原产物的物质的量之比为2:5
C.氧化剂与还原剂的物质的量之比为1:8
D.氧化剂与还原剂的物质的量之比为5:1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期第二次月考化学试卷(解析版) 题型:选择题
常温下的下列溶液,有关说法正确的是
A.某酸H2A的钠盐NaHA溶液中:c(A2-) < c(H2A),则该溶液的pH>7
B.1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0
C.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
D.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同
查看答案和解析>>
科目:高中化学 来源:2016届北京市高三上学期期中测试化学试卷(解析版) 题型:选择题
高铁酸钾(K2FeO4)是一种既能杀菌消毒、又能絮凝净水的水处理剂。工业制备高铁酸钾的反应离子方程式为Fe(OH)3+ClO-+OH-→FeO+Cl-+H2O(未配平),下列有关说法不正确的是
A.由上述反应可知,Fe(OH)3的氧化性强于FeO
B.高铁酸钾中铁显+6价
C.上述反应中氧化剂和还原剂的物质的量之比为3∶2
D.K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质
查看答案和解析>>
科目:高中化学 来源:2016届宁夏长庆高级中学高三上学期第三次月考理综化学试卷(解析版) 题型:实验题
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:

(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是________。
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为:________。
(3)过程③中,需加入的物质是________。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有___________。
(5)过程⑤调节pH可选用下列试剂中的________(填选项序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80℃,目的是___________。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.800 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省龙海市高二上学期期中测试化学试卷(解析版) 题型:选择题
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
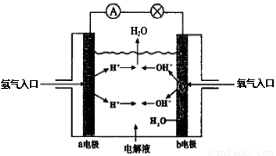
A.a电极是负极
B.b电极的电极反应为:4OH?-4e? =2H2O+O2?
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源:2016届宁夏育才中学高三上学期第四次月考化学试卷(解析版) 题型:填空题
某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处) KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作为:
A.将碘的四氯化碳溶液置于分液漏斗中;
B.加入适量Na2SO3稀溶液;
C.分离出下层液体;
D.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是 ,上述操作正确的顺序是: (填序号)
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
A.准确称取wg食盐,加适量蒸馏水使其完全溶解;
B.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
C.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示) mg/kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com