
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。

【答案】2NH3+2O2![]() N2O+3H2O BC NaNO3 NO 3HClO+2NO+H2O
N2O+3H2O BC NaNO3 NO 3HClO+2NO+H2O![]() 3Cl+2
3Cl+2![]() +5H+ 溶液pH越小,溶液中HClO的浓度越大,氧化NO的能力越强
+5H+ 溶液pH越小,溶液中HClO的浓度越大,氧化NO的能力越强
【解析】
(1)NH3与O2在加热和催化剂作用下发生氧化还原反应生成N2O,根据得失电子守恒和原子守恒可知反应有水生成,配平化学方程式为:2NH3+2O2![]() N2O+3H2O,
N2O+3H2O,
故答案为:2NH3+2O2![]() N2O+3H2O;
N2O+3H2O;
(2)①A.加快通入尾气的速率,不能提高尾气中NO和NO2的去除率,不选A;
B.采用气、液逆流的方式吸收尾气,可使气液充分接触,能提高尾气中NO和NO2的去除率,选B;
C.定期补充适量的NaOH溶液可增大反应物浓度,能提高尾气中NO和NO2的去除率,选C。
故答案为:BC;
②由吸收反应:NO+NO2+2OH-=2NO2-+H2O,2NO2+2OH-=NO2-+ NO3-+H2O可知,反应后得到NaNO2和NaNO3混合溶液,经浓缩、结晶、过滤得到NaNO2和NaNO3晶体,因此得到的NaNO2混有NaNO3;由吸收反应可知,若NO和NO2的物质的量之比大于1:1,NO不能被吸收,因此,吸收后排放的尾气中含量较高的氮氧化物是NO,
故答案为:NaNO3;NO;
(3)①在酸性的NaClO溶液中,次氯酸根离子和氢离子结合生成HClO,HClO和NO发生氧化还原反应生成NO3-和Cl-,根据得失电子守恒及电荷守恒、原子守恒,配平离子方程式为2NO+3HClO+H2O=2 NO3-+3 Cl-+5H+,
故答案为:2NO+3HClO+H2O=2 NO3-+3 Cl-+5H+;
②在相同条件下,氧化剂的浓度越大,氧化能力越强,由反应2NO+3HClO+H2O=2NO3-+3 Cl-+5H+可知,溶液pH越小,溶液中HClO浓度越大,氧化NO的能力越强,
故答案为:溶液pH越小,溶液中HClO浓度越大,氧化NO的能力越强。


科目:高中化学 来源: 题型:
【题目】反应COCl2(g) ![]() Cl2(g) + CO(g) △H>0达到平衡时各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出)。
Cl2(g) + CO(g) △H>0达到平衡时各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出)。
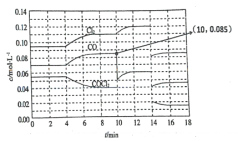
下列说法正确的是
A. 第4 min时改变的条件可能是扩大容器体积
B. 第2 min时的平衡常数K(2)大于第8 min时的平衡常数K(8)
C. 12 min时反应在温度T(8)下重新达到平衡,则此时c(COCl2) = 0.031 mol/L(结果保留两位有效数字)
D. 产物CO在2~3 min、5~6 min、12~13 min时的平均反应速率大小为:υ(5~6) > υ(2~3) > υ(12~13)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是______________。
②已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
……
iii为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用__________反应的ΔH。
③反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,目的是________________(选填字母序号)。
a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成
④用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如下图所示。从t1时开始,H2体积分数显著降低,单位时间CaO消耗率_______(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,结合化学方程式解释原因:____________________________。

(2)可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。

①制H2时,连接_______________。
产生H2的电极反应式是_______________。
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO (s)
MgO (s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3===K2O+xNa2O+16N2↑,
①x=_______________;
②该反应的氧化产物是_________,还原产物是____________,其质量比为_______;
③每生成8个N2转移________个电子;
(2)以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:

①过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是____________。
②过程Ⅰ中,Fe2+催化过程可表示为ⅰ.2Fe2++PbO2+4H++SO![]() ===2Fe3++PbSO4+2H2O ⅱ.……写出ⅱ的离子方程式:____________________________。
===2Fe3++PbSO4+2H2O ⅱ.……写出ⅱ的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。

①写出400~600 ℃范围内分解反应的化学方程式:________。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是________。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO的电极反应式:________。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是________。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH =41.2 kJ·mol1
CO(g)+H2O(g) ΔH =41.2 kJ·mol1
反应Ⅱ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=![]() ×100%
×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列关于该有机物的说法正确的是

A. 1mol 该有机物最多与4molH2反应生成C9H16O2
B. 该有机物中所有碳原子不可能处于同一平面上
C. 该有机物能发生酯化、加成、氧化、水解等反应
D. 与该有机物具有相同官能团的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的方法是将苯与浓硫酸和浓硝酸的混合液加热到 50~60℃反应。已知苯与硝基苯的基本物理性质如下表所示:
熔点 | 沸点 | 状态 | |
苯 | 5.51℃ | 80.1℃ | 无色液体 |
硝基苯 | 5.7℃ | 210.9℃ | 油状液体 |
(1)(在大试管中)配制浓硫酸和浓硝酸的混合酸的操作方法是____________________。
(2)分离硝基苯和水的混合物的方法是________;分离硝基苯和苯的方法是_________。
(3)某同学用如图装置制取硝基苯:
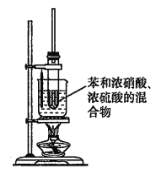
①用水浴加热的优点是________________________________________________________;
②被水浴加热的试管口部都要带一长导管,其作用是______________________________。
(4)写出此反应的化学方程式_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a> c+d
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com