

| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
| 操作 | 预期现象 |
| 取少量M固体于试管中,向其中加入足量稀硫酸;观察. | 固体完全溶解,溶液呈黄色. |
继续向上述溶液中滴入几滴(少量)高锰酸钾溶液,振荡观察 | 溶液紫红色未褪去 |
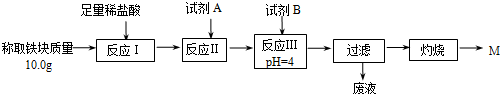
分析 (1)镁条和氯酸钾的目的是点燃镁条燃烧放热促进氯酸钾分解生成氯化钾和氧气,起到高温引发铝热反应的目的;
(2)①根据题意可知,本实验要定量检测所得“铁块”的成分,故要通过实验流程,将铁元素完全沉淀;而根据表格可知,要使铁元素完全沉淀而铝和镁不沉淀,需将Fe2+转化为Fe3+,然后沉淀,加入的试剂不能引入新的杂质;
②过氧化氢将Fe2+转化为Fe3+;
③氧化铁溶于酸生成铁离子的盐溶液,四氧化三铁溶于酸会得到铁离子、亚铁离子的混合溶液,依据铁离子和亚铁离子的检验方法和反应现象分析选择试剂,即检验是否含有亚铁离子设计实验验证;
④灼烧完全的标志是物质前后两次灼烧质量相差不大于0.1g;
⑤根据10.0g的铁块中的铁元素最终全到了最终红色粉未M中,根据铁原子的守恒来计算.
解答 解:(1)镁条和氯酸钾的目的是点燃镁条燃烧放热促进氯酸钾分解生成氯化钾和氧气,起到高温引发铝热反应的目的,使用镁条和氯酸钾的目的是引发铝热反应,
故答案为:引发铝热反应;
(2)①根据表格可知,要使铁元素完全沉淀而铝离子和镁离子不沉淀,需将Fe2+转化为Fe3+,故需要加入H2O2;然后调节4≤pH<4.2即可将Fe3+沉淀而Al3+、Mg2+不沉淀,调节pH选用的试剂不能用氧化铁,因为会引起红色粉未M的质量偏大;也不能用MgCO3固体,因为MgCO3固体过量时会引起所得固体M则质量偏大,故应选用氨水,
故答案为:C D;
②过氧化氢具有氧化性,能氧化亚铁离子为铁离子,结合原子守恒和电荷守恒配平书写得到离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3+ 2H2O;
③氧化铁溶于酸生成铁离子的盐溶液,四氧化三铁溶于酸会得到铁离子、亚铁离子的混合溶液,依据铁离子和亚铁离子的检验方法和反应现象分析选择试剂,即检验是否含有亚铁离子设计实验验证,实验证明M的成分是Fe2O3而非Fe3O4.取少量M固体于试管中,向其中加入足量稀硫酸,固体完全溶解,溶液呈黄色,继续向上述溶液中滴入几滴(少量)高锰酸钾溶液,振荡观察溶液紫红色未褪去,说明含有亚铁离子,
故答案为:
| 操作 | 预期现象 |
| 足量稀硫酸 | |
| 几滴(少量)高锰酸钾溶液 | 溶液紫红色未褪去 |
点评 本题综合考查了铝热反应以及亚铁离子向三价铁离子的转化以及离子的沉淀,化学实验基本操作,含量计算和离子检验实验设计等知识点,综合性较强,难度较大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL 2mol/L蔗糖溶液中所含分子数为0.4NA | |
| B. | 标准状况下,2.24L HF的氢原子数目为0.1 NA | |
| C. | 黑火药爆炸的方程式为2KNO3+3C+S═K2S+N2↑+3CO2↑,当生成1molK2S时转移电子数为2NA | |
| D. | 标准状况下,1.12L 1H2和0.2g2H2均含有0.1 NA质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某“焰色反应”的焰色结果为黄色,则样品中一定含“Na”元素,未必不含“K”元素 | |
| B. | 做“焰色反应”实验时,如果没有铂丝,可用铁丝代替 | |
| C. | “焰色”是金属单质或其离子燃烧时体现出来的火焰颜色 | |
| D. | 做“焰色反应“实验时,用于清洗铂丝的酸宜选用盐酸,不宜选用硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大氧气浓度,平衡正向移动,平衡常数不变 | |
| B. | 降低温度,正反应速率比逆反应速率减小的程度小 | |
| C. | 平衡时SO2气体的转化率为50% | |
| D. | 该条件下反应放出0.5QkJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| B. | 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 | |
| C. | 只含有离子键的化合物才是离子化合物 | |
| D. | 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同分异构体之间分子式相同,其式量也一定相等;式量相等的物质一定是同分异构体 | |
| B. | 某有机物燃烧后产物只有CO2和H2O,可推出的结论是有机物属于烃 | |
| C. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为CH3CH2OH | |
| D. | 分子式为C8H10的芳香烃有4种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一密闭容器中有如下反应:L(s)+aG(g)?bR(g)温度和压强对该反应的影响如图所示,其中压强P1<P2,下列判断错误的是( )
在一密闭容器中有如下反应:L(s)+aG(g)?bR(g)温度和压强对该反应的影响如图所示,其中压强P1<P2,下列判断错误的是( )| A. | 正反应为吸热反应 | B. | 化学方程式中的计量数a>b | ||
| C. | G的转化率随温度升高而增大 | D. | 增大压强,容器内气体质量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com