
甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H=-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H=-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
(1)该反应的化学平衡常数表达式为 。
(2)如反应开始时仍充入10mol CO 和20mol H2,
则在平衡状态B时容器的体积V(B)= L。
(3)关于反应CO(g)+2H2(g) CH3OH(g)在化学平衡状态时的描述正确的是 (填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是 (填字母)。
A.CO的含量保持不变
B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)
D.容器中混合气体的平均相对分子质量保持不变
(4)CO(g)+2H2(g) CH3OH(g),按照相同的物质的量 投料,测得CO在 不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 。
CH3OH(g),按照相同的物质的量 投料,测得CO在 不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 。
A.温度:T1 < T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) ="K(c)" ; K(b) >K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(5)已知CO2(g)+H2(g) CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1,试写出由 CO2和H2制取甲醇的热化学方程式 。
CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1,试写出由 CO2和H2制取甲醇的热化学方程式 。
(1)K=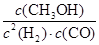 (2)4 (3)A C D (4) A
(2)4 (3)A C D (4) A
(5)CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1
解析试题分析:(1)根据平衡常数的定义可得到该反应的化学平衡常数的表达式为K=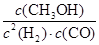 )。
)。
(2)若密闭容器中充入10 mol CO 和20 molH2,当达到平衡状态A 时,CO的转化率为0.5,此时各物质的物质的量为CO为5mol;H2为10mol; CH3OH为5mol。n(气体)=20mol,容器的体积为20 L。如反应开始时仍充入10mol CO 和20mol H2,在达到平衡状态B时CO的转化率为0.8,则此时各物质的物质的量为CO为2mol,H2为4mol, CH3OH为8mol。n(气体)=14mol。由于A、B是在相同温度下程度的。所以化学平衡常数不变设第二次达到平衡时容器的体积为v。则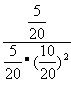 =
= ,解得v=4(L)。
,解得v=4(L)。
(3) A.CO的含量保持不变,则各组分的物质的量,总物质的量不变。可逆反应达到平衡状态。正确。B.容器中CH3OH浓度与CO浓度相等,这只是一个很特殊的情况,这时反应可能达到平衡,也可能未达到平衡状态。错误。C.在任何时刻2V正(CH3OH)=V正(H2),若2V正(CH3OH)=V逆(H2),则V正(H2)=V逆(H2),反应达到平衡。正确。D.由于该反应是个反应前后气体体积不等的反应,如果反应未达到平衡,则气体的物质的量就会发生改变,混合气体的平均相对分子质量也就会随着改变。若容器中混合气体的平均相对分子质量保持不变,则气体的物质的量不变。故反应达到平衡状态。正确。
(4)A.由于该反应的正反应是放热反应,所以在其它条件不变的情况下,升高温度,平衡向吸热反应方向移动,也就是向逆反应方向移动,这时反应物的转化率降低。因为CO的平衡转化率a>b>c,所以温度:T1 < T2 <T3。正确。B.在其它条件不变时,升高温度,化学反应速率加快。由于温度T1 < T2 <T3,所以速率:ν(c)>ν(a);在其它条件相同时,增大压强,化学反应速率加快。由于压强b>d,所以速率:ν(b)>ν(d).错误。C.化学 平衡常数只与温度有关,与其它条件无关。由于温度T1 < T2 <T3。升高温度,平衡向逆反应方向移动,K减小。K(a) >K(c) ; K(b) =K(d)。错误。D.升高温度,平衡向逆反应方向移动,平衡时气体的物质的量增大,气体的平均摩尔质量减小。由于温度T1 < T3,所以平衡时n(c)总> n(a)总,M(a)>M(c);在相同的温度下,增大压强,平衡正向移动,平衡时气体的物质的量减小。所以平衡时n(d)总> n(b)总,M(b)>M(d).错误。
(5)将CO2(g)+H2(g) CO(g)+H2O(g) △H=" +" 41.3 kJ/mol和 CO ( g ) + 2H2 ( g )
CO(g)+H2O(g) △H=" +" 41.3 kJ/mol和 CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H=-90.8 kJ/mol相加可得CO2和H2制取甲醇的热化学方程式:CO2(g) +3H2(g)
CH3OH ( g ) △H=-90.8 kJ/mol相加可得CO2和H2制取甲醇的热化学方程式:CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H=-49.5 kJ/mol.
CH3OH(g) +H2O(g) △H=-49.5 kJ/mol.
考点:考查化学平衡常数的表达式、热化学方程式的书写及平衡状态的判断、外界条件对化学反应速率、化学平衡的影响等知识。


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:填空题
节能减排是当今社会的热门话题,研发混合动力汽车对于中国汽车业的未来具有重要的战略意义。混合动力汽车持续工作时间长,动力性好的优点,无污染、低噪声的好处,汽车的热效率可提高10%以上,废气排放可改善30%以上,某种混合动力汽车的动力系统由“1.6L汽油机十自动变速器十20kW十200V镍氢电池”组成。
①混合动力汽车所用的燃料之一是乙醇,lg乙醇完全燃烧生成CO2气体和液态H2O放出30.0kJ热量,写出乙醇燃烧的燃烧热的热化学方程式 。 ②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应 。其放电时的正极的电极反应方程式为 。
②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应 。其放电时的正极的电极反应方程式为 。
③常温下,同浓度的Na2CO3溶液和NaHCO3溶液的pH都大于7,两者中哪种的pH更大,其原因是 。0.1mol·L-1 Na2CO3中阴离子浓度大小关系是 ,向0.1mol·L-1 NaHCO3溶液中滴入少量氢氧化钡溶液,则发生反应的离子方程式为: 。
(2)二氧化锰、锌是制备干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)
联合生产二氧化锰、锌的工艺如下:
①操作Ⅰ需要的玻璃仪器是 。
②软锰矿(含MnO2)和闪锌矿与硫酸反应的化学方程式为 ,上述电解过程中,当阴极生成6.5g B时阳极生成的MnO2的质量为 。
③利用铝热反应原理,可以从软锰矿中提取锰,发生的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2012年11月16日,5名男孩被发现死于贵州省毕节市七星关区街头垃圾箱内,经当地公安部门初步调查,5名男孩是因在垃圾箱内生火取暖导致CO中毒而死亡。
(1)CO中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应的化学方程式可表示为CO+HbO2 O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的
O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的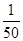 ,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的
,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的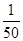 ,则吸入肺部CO的浓度不能超过______mol·L-1。
,则吸入肺部CO的浓度不能超过______mol·L-1。
(2)有如下三个与CO相关的反应:
Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=Q1,平衡常数K1
FeO(s)+CO(g) ΔH=Q1,平衡常数K1
Fe(s)+H2O(g) FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
H2(g)+CO2(g) CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
在不同的温度下K1、K2、K3的数值如下:
| T/℃ | K1 | K2 | K3 |
| 700 | 1.47 | 2.38 | 0.62 |
| 900 | 2.15 | 1.67 | |
 CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g)
CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g) CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。
CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
煤制备CH4是一种有发展前景的新技术。
I. 煤炭气化并制备CH4包括以下反应:
C(s)+H2O(g)=CO(g)+H2 (g) ΔH 1 = +131 kJ/mol
CO(g) + H2O(g)=CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol
CO(g) + 3H2 (g)=CH4 (g)+ H2O(g) ΔH 3 = ?206 kJ/mol
(1)写出煤和气态水制备CH4(产物还有CO2)的热化学方程式 。
(2)煤转化为水煤气(CO和H2)作为燃料和煤直接作为燃料相比,主要的优点有 。
(3)写出甲烷—空气燃料电池(电解质溶液为KOH溶液)中负极的电极反应式 。
II. 对以上反应CO(g) + H2O(g)  CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
| 实验编号 | 容器体积/L | 温度/°C |
| ① | 2.0 | 1200 |
| ② | 2.0 | 1300 |
| ③ | 1.0 | 1200 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2013年12月15日4时搭载长征系列火箭的“玉兔号”顺利驶抵月球表面,实现了五星红旗耀月球的创举。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4做氧化剂。请回答下列问题:
(1)已知:N2(g) + 2O2(g) ="=" 2NO2(g) ΔH= + 67.7kJ·mol-1
N2H4(g) + O2(g)="=" N2(g) + 2H2O(g) ΔH= - 534.0kJ·mol-1
2NO2(g) 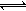 N2O4(g) ΔH=" -" 52.7kJ·mol-1
N2O4(g) ΔH=" -" 52.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: ;
(2)工业上用次氯酸钠与过量的氨气反应制备肼,该反应的化学方程式为: ;
(3)工业上可以用下列反应原理制备氨气:
2N2(g)+6H2O(l)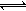 4NH3(g)+3O2(g) ΔH= Q kJ·mol-1
4NH3(g)+3O2(g) ΔH= Q kJ·mol-1
①已知该反应的平衡常数K与温度的关系如图,则此反应的 Q 0 (填“>”“<”或“=”)。
②若起始加入氮气和水,15分钟后,反应达到平衡,此时NH3的浓度为0.3mol/L,则用氧气表示的反应速率为 。
③常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号).
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.v(N2)/v(O2)=2∶3 |
| C.容器中气体的密度不随时间而变化 |
| D.通入稀有气体能提高反应的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题: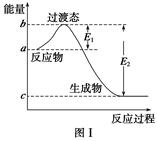
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”、“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:________________________________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0 kJ·mol-1
②CH3OH(g)+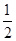 O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为______________________。
(3)如表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/kJ·mol-1 | a | b | c | x |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池的燃料,具有很好的好展前景。
(1)已知H2、CO和CH3OCH3的燃烧热(ΔH)分别为-285.5kJ/mol、-283kJ/mol和-1460.0 kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为 。
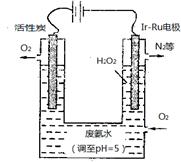
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2,将悬浮物带到水面,利于除去。实验室以二甲醚燃料电池模拟该方法设计的装置如下图所示: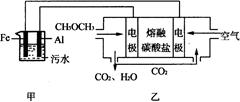
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极。写出该燃料电池的正极电极反应式 ;下列物质可用做电池熔融碳酸盐的是 。
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式: 。
③已知常温下Kap[Fe(OH)3]=4.0×10—38,电解一段时间后,甲装置中c(Fe3+)= 。
④已知:H2S的电离平衡常数:K1=9.1×10—8、K2=1.1×10—12;H2CO3的电离平衡常数:K1=4.31×10—7、K2=5.61×10—11。测得电极上转移电子为0.24mol时,将乙装置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列各项正确的是
A.发生反应的离子方程式为:CO2+S2—+H2O=CO32—+H2S
B.发生反应的离子方程式为:CO2+S2—+H2O=HCO3—+HS—
C.c(Na+)=2[c(H2S)+c(HS—)+c(S2—)]
D.c(Na+)+c(H+)=2c(CO32—)+2c(S2—)+c(OH—)
E.c(Na+)>c(HCO3—)>c(HS—)>c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。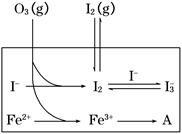
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)===IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq) HOI(aq) ΔH2
HOI(aq) ΔH2
③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
总反应的化学方程式为_________________________________,其反应热ΔH=________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3—(aq),其平衡常数表达式为________。
I3—(aq),其平衡常数表达式为________。
(3) 为探究Fe2+对O3氧化I-反应的影响(反应体系如上图),某研究小组测定两组实验中I3—浓度和体系pH,结果见下图和下表。
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
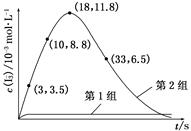
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为______________________________________;
图中变化过程哪些是吸热反应________(填序号)。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)??CH3OH(g)
方法二 CO2(g)+3H2(g)??CH3OH(g)+H2O(g)
在25℃、101 kPa下,1克甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧的热化学方程式:_____________________________________________;
某火力发电厂CO2的年度排放量是2 200万吨,若将此CO2完全转化为甲醇,则理论上由此获得的甲醇完全燃烧放热约是________kJ(保留三位有效数字)。
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2高温,TiCl4+2CO 已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=________。
(4)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8 kJ·mol-1,
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2 kJ·mol-1,
则O3转化为O2的热化学方程式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com