
������(CH3OCH3)��һ����Ҫ�����ȼ�������䴢�ˡ�ȼ�հ�ȫ�ԡ�����ȼ���¶ȵ�����ָ�������Һ��ʯ������Ҳ������ȼ�յ�ص�ȼ�ϣ����кܺõĺ�չǰ����
��1����֪H2��CO��CH3OCH3��ȼ����(��H)�ֱ�Ϊ-285.5kJ/mol��-283kJ/mol��-1460.0 kJ/mol����ҵ������ˮú���ɷְ�1:1�ϳɶ����ѵ��Ȼ�ѧ����ʽΪ ��
��2����ҵ�ϲ��õ縡Զ���۷�������ˮʱ��������ˮ��pH��5.0��ͨ���������Fe(OH)3���壬�������������ʣ�ͬʱ��������������H2�������������ˮ�棬���ڳ�ȥ��ʵ�����Զ�����ȼ�ϵ��ģ��÷�����Ƶ�װ������ͼ��ʾ��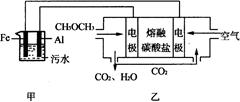
����װ��������̼����Ϊ����ʣ�ϡ����������Ϊ�缫��д����ȼ�ϵ�ص������缫��Ӧʽ ���������ʿ������������̼���ε��� ��
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
��д����װ��������������������Fe(OH)3���������ӷ���ʽ�� ��
����֪������Kap[Fe(OH)3]=4.0��10��38�����һ��ʱ���װ����c(Fe3+)= ��
����֪��H2S�ĵ���ƽ�ⳣ����K1=9.1��10��8��K2=1.1��10��12��H2CO3�ĵ���ƽ�ⳣ����K1=4.31��10��7��K2=5.61��10��11����õ缫��ת�Ƶ���Ϊ0.24molʱ������װ�������ɵ�CO2ͨ��200mL 0.2mol/L��Na2S��Һ�У����и�����ȷ����
A��������Ӧ�����ӷ���ʽΪ��CO2+S2��+H2O=CO32��+H2S
B��������Ӧ�����ӷ���ʽΪ��CO2+S2��+H2O=HCO3��+HS��
C��c(Na+)=2[c(H2S)+c(HS��)+c(S2��)]
D��c(Na+)+c(H+)=2c(CO32��)+2c(S2��)+c(OH��)
E��c(Na+)>c(HCO3��)>c(HS��)>c(OH��)
��1��3H2��g��+3CO��g����CH3OCH3��g��+CO2��g����H= ��246.4kJ/mol
��2����O2 + 4e����2CO2 ��2CO32����B
�� 4Fe2+��O2��10H2O��4Fe(OH)3����8H+
�� 4.0��10��11mol/L ��B��C��E
���������������1�����ݸ�˹���ɿ�֪����ҵ������ˮú���ɷְ�1:1�ϳɶ����ѵ��Ȼ�ѧ����ʽΪ3H2��g��+3CO��g����CH3OCH3��g��+CO2��g����H=��246.4kJ/mol����2�����Զ�����Ϊȼ�ϵĵ�أ�ͨ��ȼ�ϵĵ缫Ϊ������ͨ��O2�ĵ缫Ϊ�����������缫��ӦʽO2 + 4e����2CO2 ��2CO32����NaHCO3��(NH4)2CO3�����ֽ⣬���Բ���������̼���ε���ʡ�MgCO3��Na2CO3�������ӻ�������Ӽ�ǰ�ߴ��ں��ߣ��ۻ���Ҫ���ĸ��������������һ����Na2CO3���������ε�صĵ���ʡ� ���ڼ�װ����Al��������Fe����������������������Ӧ��Fe-2e-=Fe2+. Ȼ������Ӧ��4Fe2+��O2��10H2O��4Fe(OH)3����8H+������4Fe(OH)3���������������������ʣ��Ӷ�ʹˮ��ó��塣���ڳ�����Kap[Fe(OH)3] ="4.0��" 10��38��pH��5.0��c(OH-)=10-9mol/L, c(Fe3+)= Kap[Fe(OH)3]�� c(OH-)3=4.0��10��38�� (10-9)3= 4.0��10��11mol/L. ���ڼ���ȼ�ϵ���еĸ��������ĵ缫��ӦΪ��:CH3OCH3+3H2O=2CO2+12e-+12H+���ɼ�ÿת��6mol�ĵ��ӣ�����1��mol��CO2���壬��ת�Ƶ���0.24mol�����Բ���CO2��������ʵ���Ϊ0.24mol��6= 0.04mol.n(Na2S)=" 0.2L��" 0.2mol/L="0.04mol." ��˽�ϵ���ƽ�ⳣ�����߷�����Ӧ�ķ�ӦΪCO2+S2��+ H2O=HCO3��+HS�������A����B��ȷ��C�����������غ�ɵ�c(Na+)=2c(S2��)(��ʼ)=2[c(H2S)+ c(HS��)+c(S2��)]����ȷ��D. ���ݵ���غ�ɵã�c(Na+)+c(H+)= 2c(CO32��)+2c(S2��)+ c(OH��)+c(HCO3����+c(HS��).����E.���ݶ���֮��ķ�Ӧ�������غ�ɵ�c(Na+)= c(HCO3��)(��ʼ)+c(HS��)(��ʼ). HCO3����HS����Ҫ����ˮ�ⷴӦ��Ҫ���ģ���Ϊ����ƽ�ⳣ��H2CO3>H2S����ĵ��볣��Խ��Խ�����룬�������ˮ��̶Ⱦ�ԽС����ˮ��̶�HCO3��<HS����ˮ��̶�Խ����Һ�и����ӵ�Ũ�Ⱦ�ԽС������c(HCO3����>c(HS��)��ˮ��ʹ��Һ�Լ��ԡ�����ˮ���ܵ���˵�Ǻ����ģ������Һ�и����ӵ�Ũ�ȹ�ϵΪ��c(Na+)>c(HCO3��)>c(HS��)>c(OH��)����ȷ��
���㣺�����Ȼ�ѧ����ʽ�����ӷ���ʽ����д��ȼ�ϵ�ء����صķ�Ӧԭ��������Ũ�ȵĴ�С�Ƚϡ�


 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪H2(g)��CO(g)��CH3OH(l)��ȼ���ȷֱ�Ϊ285.8 kJ��mol��1��283.0 kJ��mol��1��726.5 kJ��mol��1����ش��������⡣
(1)��̫���ֽܷ�5 molҺ̬ˮ���ĵ������� kJ��
(2)Һ̬�״�����ȫȼ������һ����̼�����Һ̬ˮ���Ȼ�ѧ����ʽΪ ��
(3)���Լ״�Ϊȼ�ϵ�ȼ�ϵ���У��������ҺΪ���ԣ��������ĵ缫��ӦʽΪ ��
����״̬�£���ȼ�ϵ������2 mol�״����ܲ�����������Ϊ1 404.2 kJ�����ȼ�ϵ�ص�����Ч��Ϊ ��(ȼ�ϵ�ص�����Ч����ָ�������������������ȼ�ϵ�ط�Ӧ�����ͷŵ�ȫ������֮��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������̼��һ�ֱ����̼����Դ����CO2��NH3Ϊԭ�Ϻϳ������ǹ̶�������CO2�ijɹ������������غϳ����е���Ҫ��Ӧ�ɱ�ʾ���£�
��Ӧ��2NH3(g)��CO2(g) NH2CO2NH4(s) ��H1="a" kJ��mol��1
NH2CO2NH4(s) ��H1="a" kJ��mol��1
��Ӧ��NH2CO2NH4(s) CO(NH2)2(s)��H2O(g) ��H2=��72.49kJ��mol��1
CO(NH2)2(s)��H2O(g) ��H2=��72.49kJ��mol��1
�ܷ�Ӧ��2NH3(g)��CO2(g) CO(NH2)2(s)��H2O(g) ��H3=��86.98kJ��mol��1
CO(NH2)2(s)��H2O(g) ��H3=��86.98kJ��mol��1
��ش��������⣺
��1����Ӧ��ġ�H1=__________kJ��mol��1(�þ������ݱ�ʾ)��
��2����Ӧ��ġ�S______(���)0��һ����__________����������ڸ÷�Ӧ�Ľ��С�
��3����Ӧ����Ӱ��CO2ƽ��ת���ʵ����غܶ࣬��ͼ1Ϊij�ض������£���ͬˮ̼��n(H2O)/n(CO2)���¶�Ӱ��CO2ƽ��ת���ʱ仯���������ߡ�
������������ͬʱ��Ϊ���CO2��ƽ��ת���ʣ������п��Բ�ȡ�Ĵ�ʩ��________(�����)ˮ̼�ȡ�
�ڵ��¶ȸ���190���CO2ƽ��ת���ʳ�����ͼ1��ʾ�ı仯���ƣ���ԭ����__________��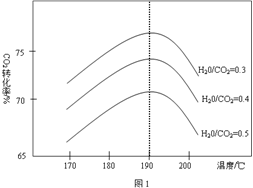

��4����Ӧ���ƽ�ⳣ������ʽK1=____________________�������ʼ�¶���ͬ����Ӧ�����ں����������и�Ϊ�ھ���(�����û����������)�����н��У�ƽ�ⳣ��K1��__________(�������١�����)��
��5��ij�о�С��Ϊ̽����Ӧ����Ӱ��c(CO2)�����أ��ں����½�0.4molNH3��0.2molCO2�����ݻ�Ϊ2L���ܱ������У�t1ʱ�ﵽƽ�������c(CO2)��ʱ��t�仯������������ͼ2��ʾ���������������䣬t1ʱ���������ѹ����1L���뻭��t1��c(CO2)��ʱ��t�仯��������(t2�ﵽ�µ�ƽ��)��
��6�������������лᷢ����ӦCO(NH2)2��2H2O (NH4)2CO3���������������������������ʵ���______��
(NH4)2CO3���������������������������ʵ���______��
| A��NH2COONH4 | B��H2NOCCH2CH2CONH2 |
| C��HOCH2CH2OH | D��HOCH2CH2NH2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״�����Ϊȼ�ϵ�ص�ԭ�ϡ�ͨ�����з�Ӧ�����Ʊ��״���CO ( g ) + 2H2 ( g )  CH3OH ( g ) ��H��-90.8 kJ��mol��1 ��һ�ݻ��ɱ���ܱ������г���10 mol CO ��20 molH2��CO ��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ�����ﵽƽ��״̬A ʱ�����������Ϊ20 L��
CH3OH ( g ) ��H��-90.8 kJ��mol��1 ��һ�ݻ��ɱ���ܱ������г���10 mol CO ��20 molH2��CO ��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ�����ﵽƽ��״̬A ʱ�����������Ϊ20 L��
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��
��2���練Ӧ��ʼʱ�Գ���10mol CO ��20mol H2��
����ƽ��״̬Bʱ���������V��B��= L��
��3�����ڷ�ӦCO(g)+2H2(g) CH3OH(g)�ڻ�ѧƽ��״̬ʱ��������ȷ���� ������ĸ����
CH3OH(g)�ڻ�ѧƽ��״̬ʱ��������ȷ���� ������ĸ����
A��CO�ĺ������ֲ���
B��������CH3OHŨ����COŨ�����
C��2V����CH3OH��=V����H2��
D�������л�������ƽ����Է����������ֲ���
��4��CO(g)+2H2(g) CH3OH(g)��������ͬ�����ʵ��� Ͷ�ϣ����CO�� ��ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���� ��
CH3OH(g)��������ͬ�����ʵ��� Ͷ�ϣ����CO�� ��ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���� ��
A���¶ȣ�T1 < T2 <T3
B������Ӧ���ʣ��ͣ�a��>�ͣ�c���� �ͣ�b��>�ͣ�d��
C��ƽ�ⳣ���� K(a) ="K(c)" �� K(b) >K(d)
D��ƽ��Ħ��������M(a)<M(c)�� M(b)>M(d)
��5����֪CO2��g��+H2��g�� CO��g��+H2O��g�� ��H=" +" 41.3 kJ��mol��1����д���� CO2��H2��ȡ�״����Ȼ�ѧ����ʽ ��
CO��g��+H2O��g�� ��H=" +" 41.3 kJ��mol��1����д���� CO2��H2��ȡ�״����Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����еIJ��ֵ�Դ��O3�Ժ�ˮ��I������������O3����ͨ��NaI��Һ�н���ģ���о���
(1)O3��I��������I2�Ĺ�����3����Ӧ��ɣ�
��I��(aq)��O3(g)=IO��(aq)��O2(g)��H1
��IO��(aq)��H��(aq) HOI(aq)��H2
HOI(aq)��H2
��HOI(aq)��I��(aq)��H��(aq) I2(aq)��H2O(l)��H3
I2(aq)��H2O(l)��H3
�ܷ�Ӧ�Ļ�ѧ����ʽΪ____________________���䷴Ӧ�Ȧ�H��__________��
(2)����Һ�д��ڻ�ѧƽ�⣺I2(aq)��I��(aq) I3��(aq)��
I3��(aq)��
��ƽ�ⳣ������ʽΪ______________��
(3)Ϊ̽��Fe2����O3����I����Ӧ��Ӱ��(��Ӧ��ϵ��ͼ1)��ij�о�С��ⶨ����ʵ����I3��Ũ�Ⱥ���ϵpH�������ͼ2���±���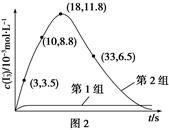 ��
��
| ��� | ��Ӧ�� | ��ӦǰpH | ��Ӧ��pH |
| ��1�� | O3��I�� | 5.2 | 11.0 |
| ��2�� | O3��I����Fe2�� | 5.2 | 4.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á�
��1���ڹ̶��ݻ����ܱ������У��������»�ѧ��Ӧ��N2��g��+3H2��g��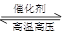 2NH3��g�� ��H=��92��4kJ/mol��
2NH3��g�� ��H=��92��4kJ/mol��
��ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
| T/K | 298 | 398 | 498 |
| ƽ�ⳣ��K | 4.1��106 | K1 | K2 |
 ��NH2��2CO +H2O
��NH2��2CO +H2O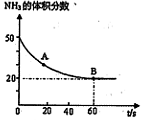
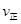 ��CO2�� B����淴Ӧ����
��CO2�� B����淴Ӧ����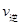 ��CO2������д��>����=����<������NH3��ƽ��ת����Ϊ____ ��
��CO2������д��>����=����<������NH3��ƽ��ת����Ϊ____ �� 2NO��g�� ��H =+180kJ/mol
2NO��g�� ��H =+180kJ/mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
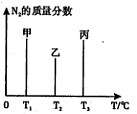
��1����ͼ��ʾ���ʯ��ʯī����ط�Ӧ�����е������仯��ϵ��
д��ʯīת��Ϊ���ʯ���Ȼ�ѧ����ʽ ��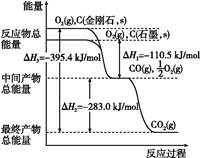
(2)��֪:Ti(s)+2Cl2(g) TiCl4(l)��H="-804.2" kJ/mol
TiCl4(l)��H="-804.2" kJ/mol
2Na(s)+Cl2(g)="2NaCl(s)" ��H="-882.0" kJ/mol
Na(s)="Na(l)" ��H="+2.6" kJ/mol
��TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)�Ħ�H= kJ/mol��
(3)��֪:
��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)��H="-a" kJ/mol
��CH3OH(l)+O2(g)=CO(g)+2H2O(l)��H="-b" kJ/mol
��H2O(g)=H2O(l) ��H="-c" kJ/mol��:2CO(g)+O2(g) 2CO2(g)�Ħ�H= kJ/mol��
2CO2(g)�Ħ�H= kJ/mol��
(4)��ҵ���ڴ��������¿�����CO�ϳɼ״�:CO(g)+2H2(g)=CH3OH(g),��ͼ��ʾ��Ӧ�����������ı仯�����
��ͼ��,���� (�a����b��)��ʾʹ���˴���;�÷�Ӧ���� (����ȡ����ȡ�)��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����еIJ��ֵ�Դ��O3�Ժ�ˮ��I������������O3����ͨ��NaI������Һ��Һ�н���ģ���о���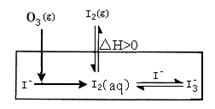
��1��O3��I��������I2�Ĺ��̿ɷ������·�Ӧ��
��I����aq��+ O3��g��= IO��(aq) +O2��g����H1
��IO����aq��+H+(aq)  HOI(aq) ����H2
HOI(aq) ����H2
��HOI(aq) + I��(aq) + H+(aq) I2(aq) + H2O(l) ��H3
I2(aq) + H2O(l) ��H3
��O3��g��+2I����aq��+2H+��aq��=��I2(aq) + O2��g��+ H2O(l) ��H4
���H3���H1����H2����H4֮��Ĺ�ϵ�ǣ���H3 = ��
��2������Һ�д��ڻ�ѧƽ�⣺ I2(aq) + I��(aq)  I3��(aq)��ƽ�ⳣ������ʽΪ ���ڷ�Ӧ������������I3�����ʵ���Ũ�ȱ仯����� ��
I3��(aq)��ƽ�ⳣ������ʽΪ ���ڷ�Ӧ������������I3�����ʵ���Ũ�ȱ仯����� ��
��3��Ϊ̽���¶���I2(aq) + I��(aq) I3��(aq) ��H5 ��Ӧ��Ӱ�졣��ij�¶�T1�£���һ������0.2 mol��L-1NaI������Һ�����ܱ������У�������һ������O3��g����O3���岻�㣬������������O2�� I����Ӧ������tʱ�̣����������I2��g����Ũ�ȡ�Ȼ��ֱ����¶�ΪT2��T3��T4��T5�£�����������ʼʵ���������䣬�ظ�����ʵ�飬������ͬʱ����I2��g��Ũ�ȣ��õ�����ͼ����ͼһ������
I3��(aq) ��H5 ��Ӧ��Ӱ�졣��ij�¶�T1�£���һ������0.2 mol��L-1NaI������Һ�����ܱ������У�������һ������O3��g����O3���岻�㣬������������O2�� I����Ӧ������tʱ�̣����������I2��g����Ũ�ȡ�Ȼ��ֱ����¶�ΪT2��T3��T4��T5�£�����������ʼʵ���������䣬�ظ�����ʵ�飬������ͬʱ����I2��g��Ũ�ȣ��õ�����ͼ����ͼһ������
������T3ʱ����������O3�� T4��T5�¶�����������I2��g��Ũ�ȳ�����ͼһ��ʾ�ı仯���ƣ����H5 0(�������)�������������¶�ΪT4ʱ����Һ��I��Ũ����ʱ��仯������������ͼ����ʾ����t2ʱ�����÷�Ӧ��ϵ�¶�������T5����ά�ָ��¶ȡ�����ͼ2�л���t2ʱ�̺���Һ�� I��Ũ�ȱ仯���������ߡ�
������T3ʱ�������л���O3����T1��T2�¶�����������I2��g��Ũ�ȳ�����ͼһ��ʾ�ı仯���ƣ�����ܵ�ԭ���� ������дһ�㣩
��4�����÷�Ӧ�ܺ�ͼ2����Ϣ������0-t1ʱ�������I2(aq)��ʾ�Ļ�ѧ��Ӧ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧ��Ҫ�о���̼Ԫ�ؼ��仯������صĺܶ���⡣
��1����̿��������ȡˮú�������12g̼��ˮ������ȫ��Ӧ����ˮú��ʱ��������131. 6kJ�������÷�Ӧ���Ȼ�ѧ����ʽ��_________ ��
��2����ҵ�Ͽ��ý�̿ұ����������0.5mol̼��ȫ�������Ӧ���õ�0.6mol����ͬʱ����2�ֳ������壬��÷�Ӧ�Ļ�ѧ����ʽ��_________��
��3��̼��ˮ������ˮú���ķ�Ӧ��һ�����淴Ӧ��������������жϸ÷�Ӧһ���ﵽƽ��״̬����_________��ѡ���ţ�����
| A��V��(H2O)=V��(H2) |
| B���������¶Ȳ��ٷ����ı� |
| C������nmolH2ͬʱ����nmolCO |
| D������������������ʵ�������ʱ��ı� |
 CO(g)+H2(g)��ƽ�ⳣ������ֵΪ_________���ڵ�5����ʱ����ϵ���·����ߵ�T2�����ڵ�8����ʱ�ﵽ�µ�ƽ�⣬������ͼ�л�����5���ӵ�9���Ӻ�c(H2O)Ũ�ȱ仯���Ƶ����ߣ�ֻҪ���Ա�ʾ����
CO(g)+H2(g)��ƽ�ⳣ������ֵΪ_________���ڵ�5����ʱ����ϵ���·����ߵ�T2�����ڵ�8����ʱ�ﵽ�µ�ƽ�⣬������ͼ�л�����5���ӵ�9���Ӻ�c(H2O)Ũ�ȱ仯���Ƶ����ߣ�ֻҪ���Ա�ʾ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com