
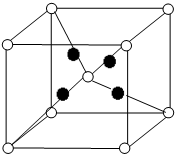
 X、Y、Z、W为短周期的主族元素,其原子序数依次增大.X元素形成的单质是自然界中含量最多的气体.Y是电负性最大的元素.W的原子最外层电子数与核外电子总数之比为3:8.X的原子序数是Z的原子序数的一半.U原子基态的外围电子排布3d104s1.
X、Y、Z、W为短周期的主族元素,其原子序数依次增大.X元素形成的单质是自然界中含量最多的气体.Y是电负性最大的元素.W的原子最外层电子数与核外电子总数之比为3:8.X的原子序数是Z的原子序数的一半.U原子基态的外围电子排布3d104s1.| 1 |
| 8 |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
| A、pH=2与pH=1的CH3COOH溶液中,c(H+)之比为1:10 |
| B、1.0mol/L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| C、仅含Na+、H+、OH-、CH3COO-离子的某溶液中可能存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、0.1mol/L的CH3COOH溶液中,由水电离出的c(H+)为1×10-13mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (14分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
(14分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(N O)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(OH-)>c(Na+)+c(H+) |
| B、由水电离出的c(OH-)=1.0×10-12mol?L-1 |
| C、与等体积pH=2的醋酸混合后所得溶液显碱性 |
| D、与等体积0.01mol?L-1氯化铵溶液混合后所得溶液中:c(Na+)=c(NH4+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com